서 론
대장의 상피성 폴립은 크게 증식폴립(hyperplastic polyp)과 샘종(adenoma)으로 나눌 수 있다[1]. 증식폴립은 일반적으로 악성화 경향이 없는 양성병변으로 알려져 있으나 하나의 폴립 내에 증식성과 선종성이 동반될 수 있다는 것이 보고되고 있고, 심지어 혼합되어 관찰되기도 한다[1,2]. 톱니샘종(serrated adenoma)은 형태학적으로 증식폴립의 전형적인 톱니모양 구조에 세포학적 이형성을 보이는 샘종으로, 하나의 샘와를 구성하는 상피세포가 증식성 및 선종성 상피의 특징을 갖는 경우를 1990년 Longacre와 Fenoglio-Preiser [1]가 처음 톱니샘종으로 명명하였고 특히, 이런 톱니샘종이 악성화하는 경향이 있다는 보고가 있은 후 더욱 주목을 받고 있다. 톱니샘종과 증식폴립, 그리고 관상샘종(tubular adenoma)간의 관계에 대해서는 아직 명확하게 밝혀져 있지 않지만 모두 암종(carcinoma)으로 변할 수 있는 것으로 알려져 있다[3,4].
우리나라에서 대장암은 식생활, 환경 변화 등의 요인으로 인해 발생 빈도가 증가하고 있어 이에 대한 관심이 고조되고 있다. 하지만 악성화 경향이 보고되고 있는 톱니샘종의 역학과 대장내시경적 특징 등에 대한 연구는 드물다. 저자들은, 대장내시경 검사에서 폴립이 발견되어 내시경 시술로 절제한 결과 고도의 이형성이 동반된 톱니샘종이 확인된 증례가 있어 이에 문헌고찰과 함께 보고한다.
증 례
53세 여자가 건강 검진에서 발견된 대장의 거대한 병변으로 인해 본원으로 전원되었다. 환자는 직장 출혈이나 복통, 배변 습관 변화, 후중감, 체중 감소 등의 증상은 호소하지 않았다. 과거력, 가족력 및 사회력에서 특이사항은 없었다. 신체 검사에서 내원 당시 혈압 130/80 mmHg, 맥박 60회/분, 호흡수 20회/분, 체온 36.5oC이었다. 병색은 보이지 않았고 의식은 명료하였다. 결막은 정상 색깔이었으며 공막의 황달은 관찰되지 않았고, 두경부 및 흉부 진찰에서 특이 사항은 없었고 복부의 압통이나 만져지는 종괴는 없었다. 내원했을 때 시행한 전혈 검사 결과는 혈색소 12.5 g/dL, 백혈구 5,000/mm3였고, 혈청 생화학검사에서 총단백 6.6 g/dL, 알부민 4.1 g/dL, AST 26 IU/L, ALT 28 IU/L, BUN 13 mg/dL, 크레아티닌 0.7 mg/dL, 나트륨 143 mEq/L, 칼륨 4.1 mEq/L이었다. 종양표지자 검사는 CEA 0.9 ng/mL, CA 19-9 13.6 U/mL였다.
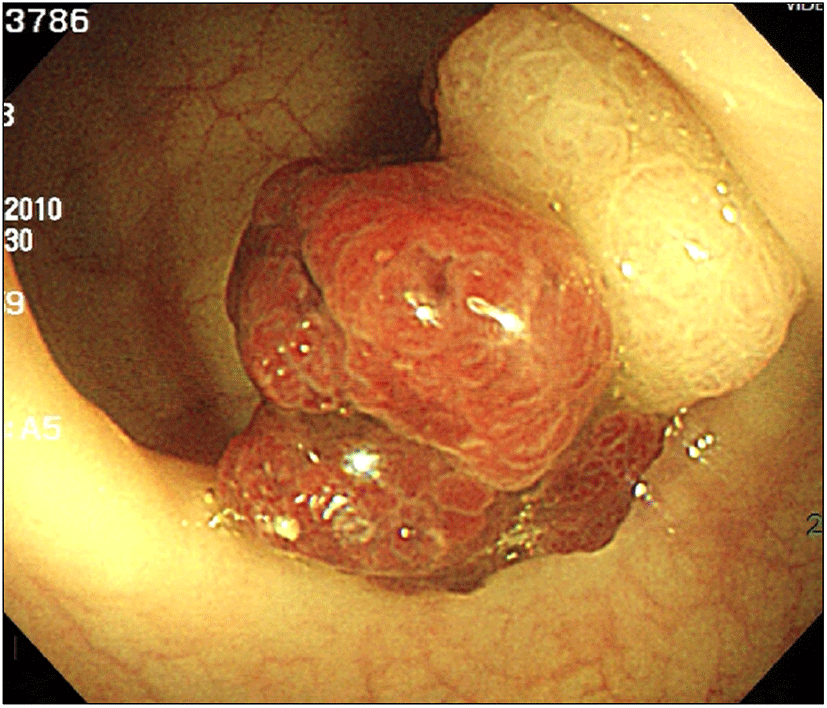
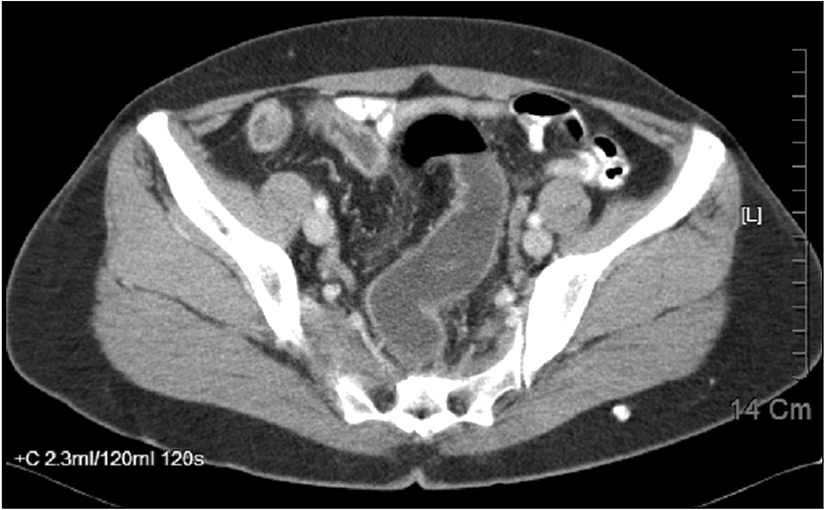
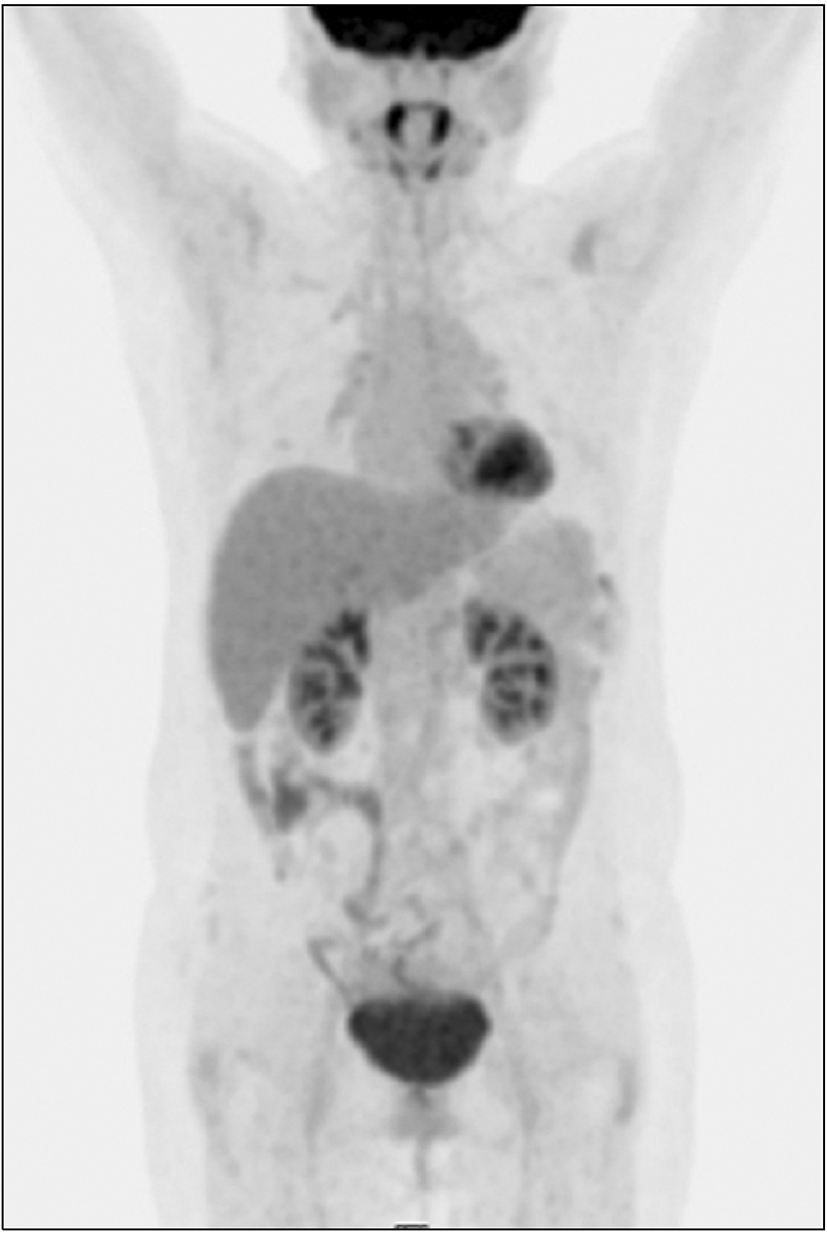
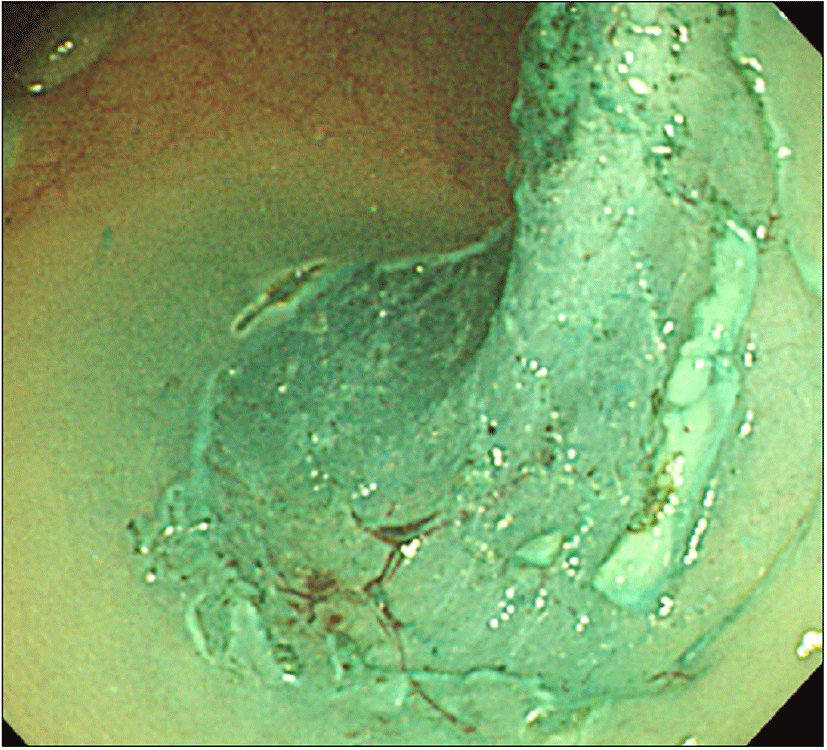
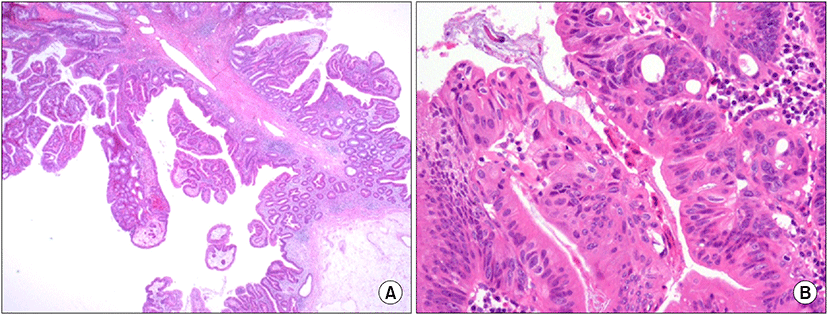
대장내시경검사에서 항문연 25 cm 상방의 구불결장에 직경 3.3 cm 크기의 무경성 폴립이 관찰되었다. 폴립은 약간 붉은색을 띄고 있는 과립결정형이었으며, 편평한 병변 위에 다시 짙은 붉은색의 유경성 폴립이 솟아있는 양상이었다(Fig. 1). 폴립의 표면에는 다양한 크기의 관상모양의 선구형태가 관찰되었다. 복부 전산화단층 촬영에서 복강 내 림프절 종대나 복수, 간전이 소견은 관찰되지 않았으며 대장 전벽이 두꺼워진 소견이나 관강의 종괴가 의심되는 소견은 없었고(Fig. 2), 전신 PET 촬영에서도 대사가 증가한 병변은 보이지 않았다(Fig. 3). 폴립의 크기가 2 cm 이상이면서 관상모양의 선구형태를 보여 암성 변화의 가능성이 있었으므로, 병변의 일괄 절제를 위해 내시경 점막하 박리술을 시행하였다(Fig. 4). 시술 후 특별한 합병증은 관찰되지 않았다. 절제된 검체에 대한 병리조직 검사결과 저배율에서 많은 부분의 상피가 톱니모양으로 관찰되었으며 구조적인 이형성이 없어서 증식 폴립을 연상할 수 있었으나(Fig. 5A), 고배율 소견에서는 일부 고도의 이형성을 보이는 핵이 관찰되었다(Fig. 5B). 환자는 최종적으로 국소적인 고도의 이형성을 지닌 톱니샘종으로 진단하였으며, 현재 외래에서 추적관찰 중이다.
고 찰
대장 내의 증식폴립은 일반적으로 양성으로 알려졌으나 증식성과 선종성이 혼합된 형태인 톱니샘종에서 대장암의 발생이 보고되면서 이러한 증식성과 선종성 폴립의 혼합형이 주목을 받게 되었다[1,3]. 조직학적으로 톱니 모양의 형태학적 특징이 있는 톱니샘종은 과거 증식폴립으로 분류되었지만, 현재는 톱니샘종을 전통적톱니샘종, 편평톱니샘종, 혼합 형태의 톱니샘종으로 분류하고 있다[4]. 전통적톱니샘종은 표면의 상피세포 샘와에 이형성을 보이며, 혼합형 톱니샘종은 증식성폴립 같은 톱니모양의 구조에 샘종의 특징인 이형성을 동반한다. 편평톱니샘종은 가장 최근에 Torlakovic과 Snover[5]에 의해 밝혀졌는데, 증식폴립과 전통적톱니샘종의 중간적인 형태적 특징을 보인다. 증식폴립처럼 무경성 형태를 유지하지만, 기저부위의 샘와는 확장되어 있으며 분지화 되어있고 점막근층과 평행하게 가장자리로 자라나는 형태를 띤다. 편평톱니샘종은 샘암종을 일으키는 원인으로 알려진 이형성 톱니샘종의 전구단계라고 보고되고 있다[6,7]. 특히, 조직학적 소견에서 세포 이형성을 보이는 경우 샘암종으로 빠르게 진행할 가능성이 있어 완전 절제를 하는 것이 좋으며, 이형성이 없는 경우에도 가능하다면 병변을 모두 제거하되 만약 내시경을 통한 절제가 어려울 경우에는 지속적으로 내시경적 추적관찰을 하도록 권하고 있다. 이에 비해 전통적톱니샘종은 이형성 여부에 따라 예후에 차이가 있지는 않으며 일반 샘종처럼 치료한다[8].
대부분의 대장암과 직장암은 유전적이지 않고, 산발적으로 발생하는데, 이곳에서 발생하는 샘암종의 80%가 adenomatous polyposis coli (APC) gene과 관계되어 adenoma-carcinoma sequence라고 불리는 유전적 메커니즘을 따라 발생한다[5,9,10]. 반면 serrated pathway는 전통적인 adenoma-carcinoma sequence와는 달리, BRAF, KRAS 등의 돌연변이와 관계되는데, 이를 통해 샘종과는 구조적으로 다른 톱니모양의 샘암종 전구병변을 만든다. Serrated pathway를 통한 대장암이 흔하지는 않으나, 산발적인 대장암 발생원인의 20%를 차지한다. BRAF oncogene은 이 과정에서 가장 흔한 유전적 변이로 high CpG-island methylation phenotype (CIMP-H), high microsatellite instability (MSI-H)와 연관된다[11,12]. BRAF 돌연변이는 편평톱니샘종과 혼합톱니샘종과 연관이 있는데, 각각 MLH1의 표현이 결여되어 있으며, 전체 톱니샘종의 2/3에서 발견된다[13]. 편평톱니샘종은 임상적으로 중년 여성의 우측 대장에서 많이 발견되고, 형태학적으로는 창백하고 납작하며, 확장된 샘와의 바닥은 톱니모양의 기하학적 구조를 보인다[14]. 전통적톱니샘종은 KRAS 돌연변이와 관계되며, 전체 톱니샘종의 30%에서 발견된다. 병변은 흔히 대장 왼편의 말단부위에 많이 발생하며, 구조는 일반적인 샘종과 비슷하나 샘와의 톱니화가 적거나 줄어든 양상을 보인다[15].
톱니샘종에 대한 치료는 결론이 나지 않은 상태로, 현재까지 이런 폴립에 대한 자료가 많지 않기 때문이다. 또한, 톱니샘종의 생활사에 대해서도 밝혀지지 않은 부분이 많다. 아직까지 재발률이나, 샘암종으로의 진행 비율에 대해서는 구체적으로 알려진바 없으나, 톱니샘종이 대장암과 직장암의 전암병변이라는 것은 확실하며[16-18], 악성화의 빈도는 약 13%로 보고되고 있다[1]. 따라서 일반적인 샘종처럼 톱니샘종 역시 치료할 것을 권장하고 있다[19,20]. 치료에 대한 권고사항들을 보면, 톱니샘종은 내시경적으로 최대한 제거해야 하며, 추적관찰을 하도록 권유하고 있다[21]. 일단 완전하게 제거한 뒤에는 내시경 시술자의 판단과 환자의 위험요소, 즉 폴립의 크기와 갯수, 대장암의 과거력이나 가족력 등에 따라 추적관찰 기간을 차별화 할 수 있다. 왼쪽 대장이나 말단에서 발견되는 톱니샘종은 대부분 크기가 작으므로 용종절제를 통해 제거할 수 있으며, 병변의 수와 크기, 이형성을 고려하여 1년에서 10년 간격으로 추적 내시경을 시행하도록 권유하고 있다[21-23]. 본 증례의 경우, 국소적인 고도의 이형성을 보이는 병변으로 내시경 시술을 통해 완전 절제가 되어 추가적인 치료는 필요하지 않지만, 대장내시경 추적은 치료 후 최소 1년 내에 시행해야 한다[24]. 톱니샘종에서 발생한 샘암종의 장기 생존율은 일반적인 대장 샘암종과 비슷한 것으로 알려져 있으며, 근위부 톱니샘종에서 발생한 샘암종이 원위부 톱니샘종에서 발생한 샘암종 보다 예후가 좋다고 보고되었다[3].
이번 증례는 구불결장의 이형성을 동반한 톱니샘종을 내시경 점막하 박리술로 치료하였는데, 톱니샘종에서 발생하는 대장 샘암종의 빈도가 향후 증가할 것으로 기대되므로 이에 대한 내시경 의사들과 병리 의사들의 관심이 필요하다.