서 론
대장암은 전 세계적으로 가장 흔하게 발생하는 악성 종양의 하나로[1,2] 매년 약 50만 명의 환자가 새로 발생하고 있으며[3] 서구에서 암으로 인한 사망 원인 중 세 번째를 기록하고 있다[1,3]. 한국에서도 이와 비슷한 양상을 보이고 있어 2008년에 발표된 한국중앙암등록본부(Korea Central Cancer Registry) 자료에 의하면 대장암의 발생률 및 사망률은 각각 3위와 4위를 차지하고 있다. 진단 시 약 70∼80%에서 수술적 완치가 가능하지만 약 50%의 환자에서 전이가 발생하는 것으로 보고되고 있다[1,4]. 따라서 환자의 생존율 향상을 위해 수술적 치료 외에 전신적 항암 요법이 널리 시행되어 왔지만, 5-FU를 기본으로 oxaliplatin이나 irinotecan과 같은 약제를 병합해서 사용하는 기존의 항암 요법만으로는 전이성 대장암 환자의 평균 생존율이 만족할 만한 수준에 이르지는 못하였다[1,4]. 이에 기존의 항암제에 저항성을 보이는 환자들의 치료 성적을 향상시키기 위해 새로운 치료법에 눈을 돌리게 되었고 이러한 관점에서 대두된 것이 표적 치료이다[4]. 현재 여러 표적 치료제가 개발 중에 있으며, 특히 세포의 성장 신호 전달을 표적으로 하는 약제의 연구가 활발히 진행되고 있는데 이 중 대표적인 것이 epidermal growth factor receptor (EGFR)를 표적으로 하는 항암제의 개발이다[5]. EGFR은 대장암을 포함하는 여러 악성 종양에서 발현이 증가하는 세포표면 수용체로 세포 내 신호전달과정을 거쳐 세포의 성장과 증식, 전이, 혈관형성, 세포사멸 등에 영향을 주게 된다[4,5]. 현재 이러한 EGFR을 표적으로 하는 몇몇 약제들이 사용되고 있으며 이는 대장암 환자들의 생존율 향상에 기여하였다. 하지만 EGFR에 mutation이 발생할 경우 이를 표적으로 하는 치료에 저항성을 보이게 되므로 이러한 mutation 발생 여부를 확인하는 것이 적절한 치료 방침을 정하는데 도움이 될 것이다. 하지만 아직까지 대장암 환자에서 EGFR mutation의 발생률에 대한 결과가 정립되지는 않았으며, 특히 한국인에 대한 연구는 거의 보고되지 않은 상태이다.
이에 본 연구에서는 한국의 대장암 환자에서 EGFR mutation의 발생률을 파악하고, 환자들의 임상 및 조직 병리학적 특성과 mutation 발생 여부와의 연관성에 대해 알아보고자 하였다.
방 법
본 연구는 2003년 1월부터 2006년 12월까지 이화여자대학교 목동병원 외과에서 대장암으로 수술을 받은 환자 58명을 대상으로 후향적으로 진행되었다. 대상 환자들의 성별이나 연령의 제한은 없었으며, 수술 전 항암치료나 방사선 치료를 시행한 경우는 연구 대상에서 제외하였다. 모든 대상 환자들은 수술 후 조직 병리학적으로 결장 또는 직장의 원발성 선암종으로 진단 받았으며 이들의 수술 검체를 연구 대상으로 하였다.
EGFR의 mutation을 평가하기 위해 QIAamp DNA Mini kit (Qiagen, Hilden, Germany)을 이용하여 수술 검체의 동결편 조직으로부터 통상적인 방법으로 DNA를 추출하였다[6]. EGFR gene의 exon 18 (codon 719), 19 (codon 746∼750), 20 (codon 787), 21 (codon 858)에 대한 primer가 증폭을 위해 사용되었다(Table 1). 10× buffer (Roche, Mannheim, Germany) 2 μL와 MgCl2 1.7∼2.5 mmol/L, 각 EGFR primer pair 0.3 μM (Roche, Mannheim, Germany), 그리고 250 μmol/L의 deoxynucleotide triphosphates와 2.5 unit의 DNA polymerase (Roche, Mannheim, Germany)가 혼합된 용액 20 μL에서 100 ng의 DNA로부터 polymerase chain reaction (PCR)을 이용하여 EGFR exon을 증폭하였다. 증폭은 94oC에서 5분간 변성시키고 이어서 94oC, 57oC, 72oC에서 각각 1분씩 30주기를 순환시킨 후, 마지막으로 72oC에서 10분간 처리하는 과정을 거쳤다. 모든 PCR 산물은 QIAgen gel extraction kit (Qiagen, Hilden, Germany)을 이용하여 2% agarose gel로부터 정제하였으며 DNA sequencing을 위한 template로 사용하였다. Sequencing은 정제된 각 PCR 산물 20 ng을 BigDye Terminator v3.1 (Applied Biosystem, Foster City, CA) 8 μL와 PCR primer 0.1 μmol/L이 포함된 20 μL의 sequencing 반응 용액에서 ABI PRISM 3100 DNA Analyzer (Applied Biosystem, Foster City, CA)를 이용하여 96oC에서 10초, 50oC에서 5초, 60oC에서 4분간 25주기를 순환시킴으로써 실행하였다. 데이터는 sequence variation을 비교하기 위해 Sequencer 3.1.1 software (Applied Biosystems, Foster City, CA)를 이용하여 분석하였다.
또한 의무기록을 바탕으로 각 환자들의 성별, 연령, 종양 표지자 및 생존기간을 포함한 임상적 특성과 병변의 위치, 병기, 분화도 및 림프절 전이 유무 등의 조직 병리학적 특성을 파악하였고, 이러한 특성과 mutation 여부와의 연관성에 대해서 함께 조사하였다.
환자들의 임상 및 조직 병리학적 특성과 mutation 여부와의 연관성은 Person’s χ2 test 및 Fisher’s exact test와 Linear by linear association을 통해 분석하였다. 또한 환자들을 mutation이 발생한 군과 발생하지 않은 군으로 분류하여 각 군의 생존기간 및 무병생존기간을 Kaplan-Meier method를 이용하여 구하였으며, 두 군에 대한 생존기간의 비교는 Log-rank test를 이용한 Univariate analysis를 통하여 시행하였다. 분석에 사용한 프로그램은 윈도우용 SPSS version 12.0 (SPSS Inc., Chicago, IL)이었으며, P값이 0.05 미만일 경우를 유의하다고 판정하였다.
결 과
대상 환자들은 총 58명으로 남성 35명(60.34%), 여성 23명(39.66%)이었으며, 이들의 평균 연령은 63.28±11.18세(범위, 36∼84세)였다. 수술 전 시행한 CEA와 CA19∼9가 정상보다 상승한 경우는 각각 17명(29.31%), 7명(12.07%)이었다(Table 2).
이들은 모두 대장암으로 수술 치료를 받았으며 수술 후 조직 병리학적으로 결장 또는 직장의 선암종으로 진단 받았다. 이들의 병변이 결장에 위치한 경우는 37명(63.79%), 직장에 위치한 경우는 21명(36.21%)이었다. 조직 병리학적으로 세포의 분화도가 고분화도인 경우가 8명(13.79%), 중등도인 경우가 45명(77.59%)이었으며 저분화도인 경우가 5명(8.62%)이었다. 림프절 전이가 발생한 경우는 25명(43.10%)이었고, 진단 시 타장기로 전이가 있었던 경우는 5명으로 모두 간전이가 발생한 경우였다. 또한 조직학적 병기는 Tis 2명(3.45%), 1기 7명(12.07%), 2기 24명(41.38%)이었으며 3기와 4기는 각각 20명(34.48%), 5명(8.62%)이었다(Table 2).
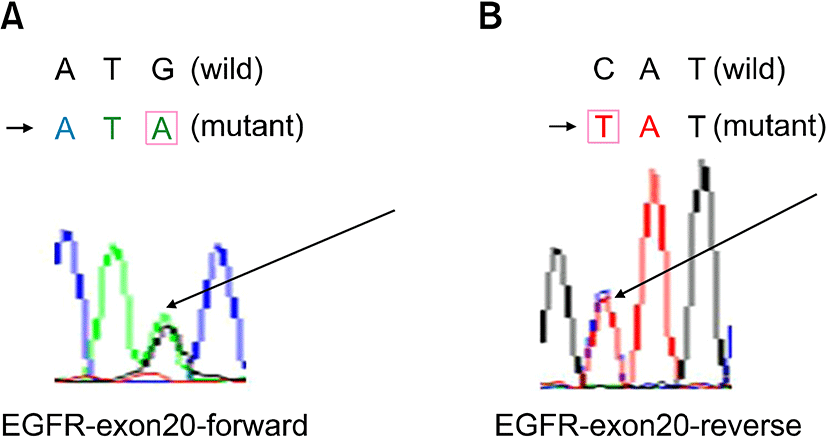
모든 검체를 대상으로 sequencing을 통해 exon 18 (codon 719), 19 (codon 746∼750), 20 (codon 787), 21 (codon 858)에서 EGFR의 mutation을 분석하였다. Sequencing 결과 58명의 환자 중 13명(22.41%)에서 exon 20에서의 EGFR mutation이 발견되었는데 이는 ATG→ATA로의 point mutation이 일어난 경우로 methionine에서 isoleucine으로의 아미노산 치환이 발생하는 결과를 가져왔다(Fig. 1). 하지만 exon 18, 19, 21에서의 mutation은 발견되지 않았다.
대상 환자들의 임상 및 조직 병리학적 특성과 EGFR mutation 여부와의 연관성에 대해 분석하였다. 조직학적 병기가 Tis∼2기인 군과 3기∼4기인 군으로 분류하여 각 군에서의 EGFR mutation 여부를 평가하였는데 Tis∼2기인 군의 환자는 33명(56.90%)으로 이 중 EGFR mutation이 발견된 경우는 총 11명이었고, 3기∼4기인 군의 환자는 25명(43.10%)으로 2명에서 EGFR mutation이 발견되었다. 두 군간의 mutation 발생 여부를 비교한 결과 조직학적 병기가 낮은 경우에 EGFR mutation이 유의하게 증가되는 결과를 보였다(P=0.028).
마찬가지로 림프절 전이 유무에 따라 환자들을 두 군으로 분류하였는데, 림프절 전이가 있는 군은 25명(43.10%), 전이가 없는 군은 33명(56.90%)이었고 이들에서 EGFR mutation이 발견된 경우는 각각 2명과 11명이었다. 이 경우 역시 림프절 전이가 없는 경우에 EGFR mutation이 유의하게 증가되는 결과를 보였다(P=0.028).
하지만 이 외에 성별이나 연령, CEA 및 CA19-9, 병변의 위치, 분화도 등의 특성과 EGFR mutation 발생 여부와의 연관성은 유의한 결과를 보이지 않았다(Table 3).
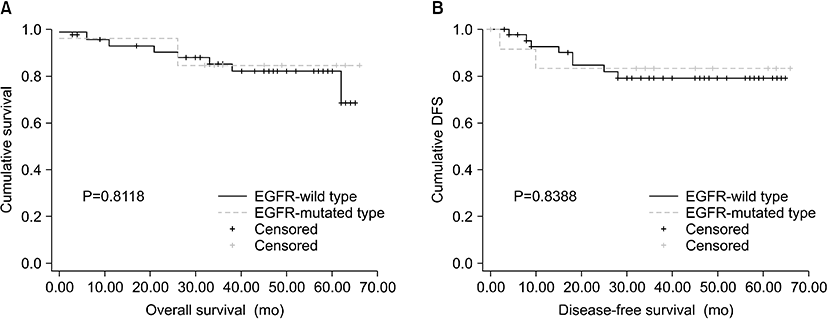
대상 환자들을 EGFR mutation 여부에 따라 두 군으로 분류하여 각 군의 생존기간(overall survival) 및 무병생존기간(disease-free survival)을 구하여 결과를 분석하였다. EGFR mutation이 발생한 환자는 13명(22.41%)으로 이들의 평균 생존기간은 57.85±5.49개월이었고 평균 무병생존기간은 56.00±6.47개월이었다. EGFR mutation이 발생하지 않은 군의 환자는 총 45명(77.59%)으로 이들의 평균 생존기간과 무병생존기간은 각각 56.66±2.79개월과 54.83±3.24개월이었다. 두 군의 생존기간과 무병생존기간을 비교한 결과 EGFR mutation 여부에 따라 유의한 차이를 보이지 않았다(Fig. 2).
고 찰
EGFR은 ErbB family의 하나로 ErbB1이라고도 불리며[7] tyrosine kinase를 포함하는 세포막 내외에 걸쳐 있는 세포 표면 수용체로 170 kD의 크기이며 1186개의 아미노산 폴리펩티드 사슬로 구성되어 있다[8]. ErbB family는 서로 다른 ligand에 의해 활성화되는 tyrosine kinase 수용체로 ErbB1 (EGFR, HER1), ErbB2 (HER2), ErbB3 (HER3), ErbB4 (HER4)로 구성되며 각각의 세포외, 세포막, 세포내 도메인을 가진다[4]. 이들의 주된 ligand로는 EGF, TGF-α, amphiregulin, betacellulin 등이 있으며[1], 이러한 ligand가 도메인에 결합하게 되면 수용체의 이합체화와 연속적인 자동인산화 과정을 거쳐 세포내 주된 신호전달과정인 Ras/ Raf/MAPK pathway와 PI3K/Akt pathway를 활성화 함으로써 종양의 분화와 전이, 혈관신생, 세포사멸 등에 관여하게 된다[1,9]. EGFR은 두경부암, 위암, 대장암, 전립선암, 췌장암, 폐암 등과 같은 여러 악성 종양에서 발현이 증가된다고 알려져 있으며[10], 특히 진행성 대장암의 경우 65∼75%에서 EGFR의 과발현이 보고되었다[1]. EGFR의 발현율과 환자의 예후와의 관계에 대한 여러 연구가 진행되었으나 아직까지 정립된 결과는 없는 상태이다. 두경부암, 난소암, 방광암, 식도암의 경우 EGFR의 발현이 환자의 생존율 감소와 관련이 있다고 보고되고 있는데 반해, 대장암에서의 연관성은 아직까지 명확하지 않다. 대부분의 보고에 의하면 대장암에서 EGFR의 발현 정도는 환자의 성별, 종양의 위치, 분화도, 연령, 림프절 전이 등의 임상적 지표들과 특별한 관련성이 없다고 하였다[11]. 그러나 EGFR의 발현 정도가 대장암의 진행 정도, 분화도, 림프절 전이 및 재발과 연관이 있다는 보고들도 있다[5]. EGFR을 표적으로 하는 치료는 크게 두 가지로 대표할 수 있는데, ligand가 세포외 도메인에 결합하는 것을 차단하는 단클론 항체와 세포내 신호전달 경로를 차단하는 tyrosine kinase inhibitor이다[1]. 현재 사용되고 있는 단클론 항체로는 cetuximab, panitumumab 등이 있으며 irinotecan이나 oxaliplatin에 저항성이 있는 대장암 환자에서 이를 단독 또는 병합해서 사용할 경우 효과가 있는 것으로 보고되었다[1]. 또한 tyrosine kinase inhibitor로는 gefitinib, erlotinib 등이 있으며 이는 주로 소세포성 폐암 환자에서 사용되고 있으며 대장암 환자에서는 효과가 적은 것으로 알려져 있다[1].
대장암 환자에서 주로 사용되고 있는 항암제로는 5-FU, oxaliplatin, irinotecan 등이 있으며 대장암의 발병기전에 EGFR 및 K-ras에 의한 신호전달 경로가 관여함이 밝혀짐에 따라 기존의 항암제에 저항성을 보이면서 EGFR이 발현되어 있는 경우에 이를 표적으로 하는 치료가 시행되고 있다. 하지만 이러한 약제에 저항성을 보이는 사례가 보고됨에 따라[12] 이러한 현상에 EGFR의 mutation이 관여할 것이라는 의견이 제기되면서 이에 대한 연구를 통해 이러한 mutation을 보이는 환자의 비율을 파악하고 이를 바탕으로 이들에게 적합한 치료법을 개발하고자 하는 노력이 일고 있다.
EGFR mutation에 대한 연구는 주로 소세포성 폐암을 대상으로 진행되어 왔으며 약 45%의 mutation이 발생한다고 보고되고 있다[13]. 지역에 따른 몇몇 연구가 진행되었는데 그리스에서 발표한 결과에 따르면 소세포성 폐암 환자의 28%에서 EGFR mutation이 발견되었다고 하였고[14], 한국의 환자를 대상으로 한 연구에 따르면 EGFR mutation의 발생률이 15%라고 보고하였다[15]. 한국에서 발표된 또 다른 연구에 의하면 24%로 좀 더 높은 발생률을 보고하였고, EGFR의 mutation 여부와 환자들의 연령이나 성별, 병기, 분화도와 같은 임상병리학적 특성과의 연관성에 대해 함께 분석하였는데 의미 있는 결과를 보이지는 않았다[6]. EGFR mutation에 대한 여러 연구가 발표된 소세포성 폐암과 달리 대장암에서는 EGFR mutation의 발생률에 대해서만 일부 보고되었으며 이 외에 환자들의 임상병리학적 특성과 mutation과의 연관성에 대한 연구 결과는 거의 없는 상태이다[13,16]. 서구 사회에서 발표된 몇몇 연구에 따르면 대장암 환자에서 EGFR mutation의 발생률은 매우 낮게 보고되고 있는데, 293명을 대상으로 한 Barber 등의 연구에서는 0.34%의 발생률을 보고하였고[16], 30명을 대상으로 한 Ogino 등의 연구에 의하면 한 명(3.3%)의 환자에서 exon 18에서의 mutation이 발생하였다고 보고하였다[17]. 한편 일본에서 발표된 연구에 의하면 서구 사회보다 다소 높은 mutation 발생률을 보이고 있는데, Nagahara 등은 33명의 대장암 환자 중 4명인 12%에서 EGFR mutation이 발생하였다고 하였고 이는 exon 19와 20에서 각각 2명씩 발생하였다[13]. 본 연구에서는 한국의 대장암 환자를 대상으로 EGFR mutation의 발생률에 대해 조사하였는데 58명의 환자 중 총 13명인 22.4%에서 mutation이 발생하였으며 이는 모두 exon 20에서 발견되었다. 환자들의 조직학적 병기가 낮고 림프절 전이가 없는 경우에 EGFR mutation이 유의하게 증가하는 양상이 관찰되었으나, 생존기간과 무병생존기간과는 유의한 연관성을 보이지 않았다. 이 외에 성별이나 연령, CEA 및 CA19-9, 병변의 위치, 분화도와 같은 임상병리학적 특성과 mutation 여부와의 연관성에 대해서도 조사하였으나 유의한 결과를 보이지 않았다.
본 연구에서는 대상 환자 수가 적다는 점과 후향적 연구라는 점, 본원의 환자들만을 대상으로 하여 연구 결과를 전체 대장암 환자에게 적용하기 어렵다는 점, 그리고 대상 환자들이 동일한 치료를 받지 않아 EGFR mutation의 여부와 임상 결과와의 상관 관계에 대해 적절한 평가를 할 수 없다는 점 등을 제한점으로 들 수 있으나, 대장암 환자의 EGFR mutation에 대해 정립된 연구 결과가 없는 현 시점에서 EGFR mutation의 발생 빈도에 대해 조사하였다는 점에서 의미가 있다고 하겠다.
본 연구에서 한국의 대장암 환자의 EGFR mutation의 발생률은 22.41%였으며, 환자의 병기가 낮은 경우와 림프절 전이가 발생하지 않은 경우에 유의하게 증가하는 결과를 보였다. 추후 더 큰 모집단을 대상으로 하는 연구가 진행된다면 더 의미 있는 결과를 얻을 수 있을 것이며, 대장암 환자에서 표적 치료를 시행하기 전에 EGFR의 mutation 여부를 파악하는 것이 필요할 것으로 생각된다.