서 론
휴식 상태에서의 신장은 지속적으로 혈장을 여과하여 체액의 용적, 삼투압농도, 산도 및 다양한 전해질 수치가 정상으로 유지되도록 신체 구성성분을 조절한다. 대부분의 마취제는 혈압과 심박출량을 저하시켜 신혈류량을 감소시키고, 사구체 여과율과 소변형성을 억제시킨다. 수술과 마취는 자율신경계에도 영향을 미치는데, 순환 카테콜아민이 증가하여 신혈관 저항을 변화시키고 신혈류량이 저하되어 사구체 여과율을 감소시킨다. 또한, 신경외과 수술과 같은 대수술의 주술기 스트레스 반응은 순환 항이뇨 호르몬 수치를 증가시켜 소변 배출량이 줄어든다[1]. 전신 마취하에서 수술 중 적절한 소변 배출량은 0.5 mL/kg/hr 이상이다.
정상인의 1일 소변 배출량은 1,500 mL 정도이다. 다뇨증은 1일 소변 배출량이 3,000 mL 이상인 병적인 상태로 정의되며, 원인은 대사성 질환, 생화학적 이상, 구조적 문제, 자가 면역 질환, 내분비 질환, 약물 등으로 다양하다[2]. 전신 마취하 수술 중 다뇨증의 원인은 대부분 수술 전 투여한 약물이나, 요붕증, 외상에 따른 항이뇨분비이상증후군(syndrome of inappropriate secretion of antidiuretic hormone), 수액의 과잉공급 등이 차지하고 있다. 전신 마취하 수술 중 다뇨증으로 인해 많은 합병증이 야기될 수 있으므로, 원인을 파악하고 그에 따른 적절한 처치가 필요하다. 저자들은 sevoflurane을 이용한 전신마취 하에서 귀밑샘 절제술 중 발생한 심각한 다뇨증을 경험하였기에 문헌고찰과 함께 증례를 보고하고자 한다.
증 례
신장 179 cm, 체중 70 kg인 59세 남자환자가 내원 3개월 전 발견된 왼쪽 볼 종괴를 주소로 내원하였다. 과거 병력상 10년 전에 고혈압과 당뇨를 진단 받은 후 약물치료를 받고 있었으며, 2년 전 말어눌 증세로 뇌졸중을 진단받아 그 후 약물치료를 받고 있었다. 이학적 검사상 특이소견은 발견되지 않았으며, 혈액검사, 흉부 방사선, 심전도 검사 등 마취 전 검사에서도 이상소견은 발견되지 않았다. 수술 전 복용하고 있던 약물은 amlodipine, olmesartan, metformin, vildagliptin, pitavastatin, clopidogrel, choline alfoscerate, trimetazidine, carbamazepine, itopride이었고, clopidogrel은 수술 7일 전부터 중지한 상태였다.
환자는 입원 후 2일째 귀밑샘 절제술을 시행하였고, 마취 전 투약은 실시하지 않았다. 수술실 도착 후 비침습적 혈압 측정기, 심전도, 맥박산소 포화도 측정기로 활력 징후를 감시하였다.
입원 후 병동에서의 혈압은 수축기 혈압 110∼130 mmHg, 이완기 혈압 70∼80 mmHg이었고, 마취 전 혈압은 150/80 mmHg, 맥박은 78회/분, 맥박산소 포화도는 100%였다. 마취유도 전에 마스크로 100% 산소를 충분히 공급한 후에 glycopyrrolate 0.2 mg을 정맥주입 후 midazolam 5 mg, thiopental sodium 250 mg, rocuronium 50 mg, fentanyl 100 μg을 정주하여 마취유도를 시행하였고, 기관내 삽관 전 lidocaine 80 mg을 정맥주입한 후 기관내삽관을 시행하였다. 마취 유지는 50% N2O, 50% O2, sevoflurane 1∼2%를 흡입시켜 조절호흡을 시행하였다.
마취 유도 직후 혈압은 175/105 mmHg이었고, 이후 수축기 혈압 90∼100 mmHg, 이완기 혈압 60∼70 mmHg를 유지하였다. 수술 시작 5분 후 혈압 80/55 mmHg로 감소하여 ephedrine 5 mg 투여하였고, 수술 시작 50분 후 다시 혈압 78/55 mmHg로 감소하여 ephedrine 5 mg 투여 후 침습적 동맥압 측정을 위해 요골동맥 내 도관을 거치하고, 동맥혈 가스 분석을 시행하였다. 동맥혈 가스 분석 결과 pH 7.45, PCO2 34 mmHg, PO2 153 mmHg, BE 0.0, SaO2 99%이었고, 전해질 수치는 나트륨 139 mEq/L, 칼륨 3.8 mEq/L, 이온화된 칼슘 4.29 mEq/dL이었다. 마취 유도 후 90분 동안 수액은 900 mL 주입되었고, 소변 배출량은 400 mL이었다.
수술 시작 1시간 후에 혈압이 80/55 mmHg로 감소하여 dopamine 5 μg/kg/min으로 지속 정주를 시작하였고, 이후 환자의 활력 징후는 안정되었다. 수액 주입을 위해 오른쪽 다리에 정맥도관을 거치하고, 결정질 용액을 주입하기 시작하였다. 이후 수축기 혈압은 130∼140 mmHg, 이완기 혈압은 60∼70 mmHg를 유지하였고, dopamine 지속 정주를 시작한 지 1시간 후 지속 정주량을 점점 줄이려 하였으나 수축기 혈압이 다시 90∼100 mmHg로 하강하는 소견을 보여 다시 dopamine 5 μg/kg/min으로 지속 정주를 유지하였다.
이후 2시간 동안 시간당 수액 주입량은 결정질 용액 1,000∼1,200 mL를 유지하였고, 시간당 소변 배출량은 600∼700 mL이었고, 환자의 활력징후는 안정적이었다. 마취 유도 후 3시간째에 측정한 동맥혈 가스 분석 결과는 pH 7.46 PCO2 37 mmHg, PO2 113 mmHg, base excess 2.5, SaO2 99%이었고, 전해질 수치는 나트륨 146 mEq/L, 칼륨 3.8 mEq/L, 이온화된 칼슘 4.25 mEq/dL이었다.
마취유도 5시간 30분 후 dopamine 주입을 중단하였고, 이때까지의 총 수액 주입량은 5,850 mL이었고, 총 소변 배출량은 5,000 mL, 수술 중 발생한 출혈량은 약 400 mL 정도였다. 혈장 오스몰 농도와 소변 오스몰 농도를 포함한 검사실 검사를 시행한 결과 혈색소 11.9 g/dL, 적혈구 용적률 34.5%, 혈소판 115 K, 프로트롬빈 시간/활성화 부분트롬보플라스틴 시간 10.6 sec/101.0 sec (INR 0.99), 혈장 오스몰 299 mOsm/kg (범위, 289∼308), 소변 오스몰 362 mOsm/kg (범위, 300∼900)으로 모두 정상 수치를 나타내었다.
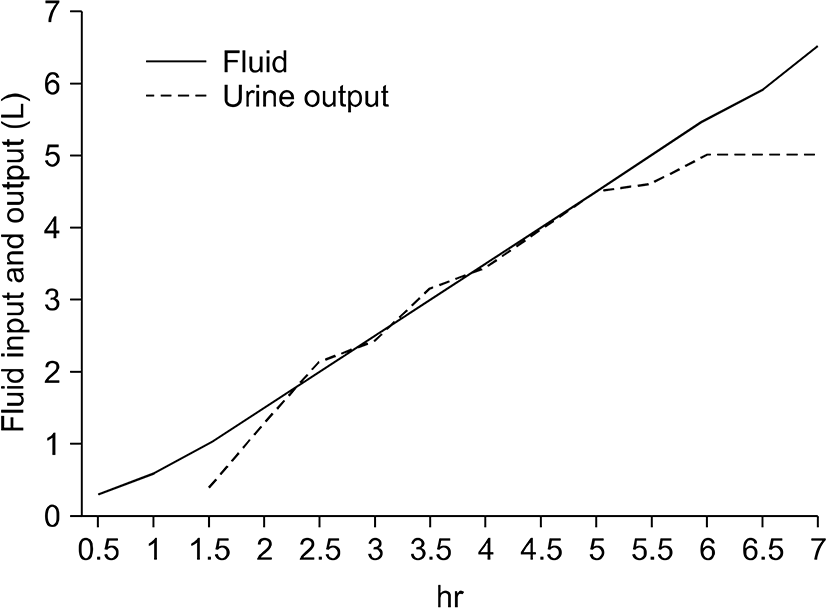
이후 수술이 끝날 때까지 1시간 20분 동안 수축기 혈압 100∼110 mmHg, 이완기 혈압 55∼65 mmHg를 유지하였다. 수술이 끝나고 환자를 깨우기 시작할 때부터 혈압은 오르기 시작하여 발관 시 혈압은 150/80 mmHg 정도를 유지하였으며, 의식 회복, 근이완 회복을 확인 후 발관하고 회복실로 이송하였다. 수술시간은 총 6시간 30분이었고, 마취시간은 7시간 5분이었다. 총 투여된 수액량은 결정질 용액 6,000 mL, 교질 용액 500 mL로 총 6,500 mL이었고, 추정 출혈량은 약 400 mL, 총 소변 배출량은 5,000 mL로 총 배출량은 5,400 mL이었다. 수술 중 환자에게 약 13 mL/kg/hr의 수액이 투여되었고, 소변 배출량은 11 mL/kg/hr로 측정되었다(Fig. 1).
이송 후 의식은 또렷하였고, 활력징후도 안정적으로 유지되었다. 수축기 혈압은 130∼140 mmHg, 이완기 혈압은 70∼80 mmHg로 유지되었고, 동맥혈 가스 분석 결과 pH 7.37, PCO2 46 mmHg, PO2 132 mmHg, BE 1.3, SaO2 99%이었고, 전해질 수치는 나트륨 147 mEq/L, 칼륨 3.4 mEq/L, 이온화된 칼슘 4.29 mEq/dL 이었다. 회복실에서 45분간 활력징후 관찰 후 비강 배관에 의한 산소투여법으로 5 L/min의 산소를 공급하면서 병실로 이송되었다. 회복실에서 주입된 수액량은 총 60 mL이었고, 소변 배출량은 400 mL이었다.
수술 다음날 찍은 단순 흉부 촬영에서 심비대와 양쪽 폐에 폐부종이 의심되는 소견을 보였고, 환자는 호흡곤란이나 가슴 답답함 등 다른 증상을 호소하지는 않았다. 수술 후 6일째에 시행한 단순 흉부 촬영에서는 심비대 이외에는 특이소견 발견되지 않았고, 환자는 7일째에 경과 호전되어 퇴원하였다(Table 1).
고 찰
본 증례는 sevoflurane을 이용한 전신 마취하에서 귀밑샘 절제 수술 중 발생한 다뇨증의 원인을 분석해 보고자 한다.
수분중독에 의한 다뇨는 설사나 구토 후 또는 외과적 수술 후에 수분만을 대량으로 공급할 때 일어나는 경우가 대부분이고, 저나트륨혈증과 더불어 두통, 구토, 발한, 주의력 저하, 경련, 혼수 등의 증상이 나타난다. 본 환자에서는 수분을 다량으로 섭취하였다는 증거를 찾을 수 없었고, 수술 전날 자정부터 수술을 위해 금식상태였기 때문에 수분 섭취는 불가능 하였다. 마취 중 총 수액 요구량은 수술 전 금식기간 동안의 부족량 880 mL, 수술 중 수액 유지랑 720 mL, 출혈량 400 mL, 소변 배출량 5,000 mL으로, 총 7,000 mL의 수액이 필요하였고, 본 환자에서는 결정질 용액 6,000 mL, 교질 용액 500 mL로 총 6,500 mL이 투여되었다. 또한 수술 전, 수술 중 여러 번 시행한 전해질 검사에서 저나트륨혈증을 포함한 전해질 이상은 없었으므로 수분중독은 원인에서 제외된다.
혈액 검사상 혈액요소질소, 크레아티닌, 전해질 수치, 요검사 등이 모두 정상이었으므로 신장질환은 제외되며, 뇌졸중 검사 중 시행한 뇌자기공명영상에서도 종양성 질환이나, 구조적 이상 소견을 보이지 않았다. 또한, 얼굴 전산화 촬영에서도 왼쪽 귀밑샘의 선종 이외에 다른 종양성 질환을 찾을 수 없었다. 귀밑샘 선종은 Warthin's tumor로 확진되었고, 이 종양의 병리학적 발생과정에 대해서는 아직까지 정확히 밝혀지지 않았다. Teymoortash 등[3]의 연구에 따르면 귀밑샘의 Warthin's tumor에서 steroid hormone receptor가 발견되었고, 이는 위 종양의 발생에 내분비적 요소가 관여했을 것이라는 점을 추측해 볼 수 있다고 하였다. 하지만 위 사실로 본 환자에서의 다뇨를 설명할만한 근거를 찾을 수는 없었다. 따라서 본 증례에서는 환자의 기저질환에 의한 내분비계 이상이나 환자가 평소에 복용하던 약물, 수술 중 사용한 마취제와 약물 등을 다뇨증의 원인으로 생각해 볼 수 있겠다.
흡입 마취제가 이산화탄소 흡수제와 상호작용 시 생성되는 신독성 물질에 대한 연구에서 고온 저유량의 호흡회로에서 이산화탄소 흡수제는 sevoflurane을 분해하여 compound A를 생성한다[4]. Compound A의 몇몇 대사물은 신장 손상을 일으킬 수 있는데, 이뇨, 당뇨, 단백뇨, 혈장 BUN, 그리고 크레아티닌 수치의 증가가 특징이다. 최근 연구들에서, 2 L/min 이상 유량의 sevoflurane을 이용한 전신마취는 compound A 독성과는 연관이 없다고 한다[5]. 본 환자에서는 soda lime을 사용하였으나, 수술 중 sevoflurane 유량을 3 L/min로 유지하여 다뇨증과의 뚜렷한 연관성을 찾아볼 수 없었다.
Sekeroglu 등[6]의 연구에 따르면 2% end-tidal sevoflurane의 고유량 6 L/min 마취는 급성 사구체 기능이상을 초래하지만 신세뇨관 손상을 일으키지는 않는다는 것을 증명하였다. sevoflurane을 이용한 전신마취 후 신세뇨관 기능을 나타내는 leucine aminopeptidase (LAP)는 변화가 없었고, gamma-glutamyl transferase (GGT), alkaline phophatase (ALP)는 마취 한시간 후에 증가하였으며, lactate dehydrogenase (LDF)는 마취 두 시간째에 증가하였다. 이들은 마취 종료 후 8시간에 정상치로 회복되었지만, urinary albumin excretion은 유의하게 증가한 소견을 보였다.
하지만 몇몇 증례에서 sevoflurane을 사용한 전신마취에서 다뇨증이 관찰되는 경우가 보고되고 있다. Schirle [7]의 증례보고와 Lee 등[8]의 증례보고에 따르면 다른 전신질환이나 신장질환을 가지지 않는 환자에서 sevoflurane 마취 중 다뇨증이 보고되었는데, sevoflurane 마취 자체로 가역적인 신기능의 이상을 초래할 수 있다고 보고하였다.
Morita 등[9]의 연구에 따르면 sevoflurane을 사용한 전신마취군에서 propofol을 사용한 전신마취군보다 aquaporin2 (AQP2), 소변 삼투압과 소변 나트륨 배출량이 현저히 감소하였다고 보고되었다. 신장에서 요농축을 하는 부위는 헨레고리와 집합관으로 ADH에 의해 집합관에서 AQP2가 생성되어 물의 재흡수가 일어나게 되는데 sevoflurane을 사용한 전신마취에서 AQP2의 배출이 지연되고 소변 삼투압의 변화로 인해 AQP2의 배출에 영향을 미쳐 일시적으로 요농축 능력이 떨어질 수 있다.
본 증례에서 환자는 고혈압 조절 목적으로 Sevikar를 복용하고 있었는데, 이 약물은 amlodipine besylate와 olmesartan medoxomil의 복합체이다. amlodipine은 칼슘채널 차단제로 칼슘이온이 심장 및 혈관 평활근의 세포막으로 유입되는 것을 차단하는 작용을 하는데 amlodipine은 평활근에 직접 작용하며, 말초혈관의 저항을 감소시키고 혈관확장 작용으로 항고혈압 작용을 나타낸다[10]. 또한, olmesatan medoxomil은 위장관에서 흡수되면서 olmesatan으로 가수분해되는 prodrug으로, renin angiotensin-aldosterone system에 작용하여 angiotensin II 수용체 중 AT1을 선택적으로 차단함으로서 angotensin II에 의한 혈관 수축을 억제하는 한편, aldosterone 분비를 억제함으로써 수분의 재흡수를 억제하여 강압효과를 나타낸다[11]. Colson 등[12]의 연구에 따르면 지속적으로 angiotensin-converting enzyme inhibitors (ACEIs)를 복용해온 환자는 전신마취와 관련하여, 몇 가지 위험을 동반하게 되는데, 혈압저하와 서맥 등을 관찰할 수 있었다. 전신마취와 관련하여, ACEIs를 복용하는 환자군은 다른 항고혈압제를 복용하는 환자군에 비하여 마취 유도 시 parasympathetic tone의 증가와 급격하게 줄어드는 심실 전부하를 보상하기 위하여 심박출량의 변화를 관찰 할 수 있었다. 이에 따라, 전신혈관 저항이 낮아지면서 혈압이 하강하게 되고, 이를 보상하기 위하여 많은 수액이 필요하게 된다. 이는 소변 배출량의 증가와의 연관성을 시사한다. 또한 aldosterone 분비를 억제함으로써 수분의 재흡수를 억제하는 과정에서 소변 배출량의 증가를 예상할 수 있다.
Fraser와 Arieff [13]에 따르면, 11명의 건강한 여성이 증상을 동반한 저나트륨혈증을 보인 뒤, 다뇨증, 고나트륨혈증, 고혈당증을 보이다가 사망한 사례가 있었다. 부검 소견상 위 환자들은 정상 신장과 뇌하수체 후엽 경색증을 보여 중추성 요붕증으로 진단되어, 치료되지 않은 증상이 있는 저나트륨혈증이 중추성 요붕증을 야기할 수 있다는 사실이 확인되었다. 요붕증은 vasopressin이 기능을 하지 않는 질환으로 신장이나 중추성 원인으로 인해 발생하는데, 중추성 요붕증은 vasopressin의 생산이나 분비에 이상이 원인이고, 신장성 요붕증은 vasopressin에 신장이 반응하지 않는 것이 원인이다. 요붕증은 24시간 소변 배출량이 50 mL/kg를 초과하고, 24시간 소변삼투압이 300 mOsm/kg 미만일 때 진단될 수 있다[14]. 본 환자에서 측정한 소변삼투압, 혈장삼투압이 모두 정상이었으므로, 중추성 요붕증은 배제할 수 있었고, 신장에 특별한 문제가 발견되지 않았기 때문에 신장성 요붕증도 배제할 수 있었다.
본 증례에서는 혈압 유지를 위하여 dopamine을 지속정주 하였는데 이 또한, 소변 배출량의 증가와 연관이 있을 것이다. Dopamine은 내인성 catecholamine으로 용량에 비례하여 각각 다른 catecholamine 수용체에 영향을 미친다. 성인에서, 0.5∼2 μg/kg/min으로 투여 시 dopaminergic effect를 주로 나타내게 되고, 5∼10 μg/kg/min으로 투여 시 β-adrenergic effect를 주로 나타내게 된다. 10∼20 μg/kg/min으로 투여 시에는 α-adrenergic effect를 주로 나타내게 된다[15].
McDonald 등[16]의 연구에 따르면 저용량의 dopamine 투여는 신장보호 효과를 가진다고 한다. 하지만 최근 여러 가지 임상적 연구들에서 dopamine 투여로 인한 여러 합병증들이 보고되었고, Debaveye 등[17]의 연구에 따르면 저용량의 dopamine 지속 정주는 신장 혈관을 이완시켜, 신혈류를 증가시키고, 이에 따라 소변 배출량을 증가시킨다. 이는 또한 정상 혈량을 가진 환자나 저혈량증 환자에서 모두 급성신부전의 위험을 증가시키는 것으로 나타났다. 본 증례에서도 저용량의 dopamine의 장시간 지속정주로 인해 신혈류의 증가가 일어나 소변 배출량 증가의 요인으로 작용하였을 것으로 생각된다.
또한 수술 중 발생한 저혈압을 교정하기 위해 정맥도관을 추가로 거치하고, 결정질 용액을 주입하면서 수액부하량이 늘어난 것도 소변 배출량의 증가와 연관이 있을 수 있다. 정맥도관 추가 거치 후, 수액 주입량이 시간당 결정질 용액 300 mL에서 1,000∼1,200 mL로 증가한 것을 관찰할 수 있었다. 과도한 요배출의 보충을 위해 수액 부하량이 증가하였지만, 수액 부하량의 증가 자체가 소변 배출량의 증가를 촉진시켰을 가능성도 고려해 볼 수 있겠다.
위의 여러 가지 요인들을 고려해 봤을 때, 본 증례에서는 환자가 복용하고 있던 약물, sevoflurane 등 여러 인자들이 소변 배출량에 관여했으리라 생각된다. 각각의 원인을 고려하여 적절한 대응방안을 마련하고, 마취 중 적절한 소변 배출량을 유지할 수 있도록 수액 투여량을 유지하며, 기질적 원인을 배제하여 이로 인한 합병증을 예방하여야 할 것이다.