서 론
유전분증은 섬유상 단백질이 세포 외에 비정상적으로 침착되어 전신질환의 일부로 나타나 여러 장기를 침범하기도 하고 한 가지 장기에 국한되어 나타나기도 한다[1,2]. 유전분증은 특별한 원인이 없이 발병하는 원발성 유전분증(AA)과 감염, 만성질환, 악성질환 등과 동반해서 나타나는 속발성 유전분증(AL)으로 분류된다. 원발성 유전분증은 특별한 원인 없이 항체를 구성하는 단백질이 몸에 축적되어 발생하는데, 단백 섬유가 축적되는 대표적인 부위는 심장, 폐, 피부, 혀, 혈관, 신장, 간, 갑상선이다. 속발성 유전분증은 다발성 골수종, 결핵, 골수염과 같은 만성 감염 혹은 류마티스관절염과 같은 만성염증질환에서 아포지단백 전구체(apolipoprotein precursors)가 여러 장기에 축적되어 발생한다. 또한 부신, 림프절, 간, 비장, 신장 등에 흔히 발생하며, 위장관에 발생한 경우는 흡수장애와 가성 장폐색 및 단백상실성 위장증(protein losing enteropathy)을 유발한 증례가 보고된 바 있다.
그러나 Clostridium difficile (C. difficile) 장염에 속발된 유전분증에 대한 보고는 매우 드물며, 이로 인하여 독성장염이 발생한 증례보고는 없다[3,4]. 이에 저자 등은 고관절치환술 후 장기간 항생제 사용으로 인한 C. difficile 장염환자에서 이차성으로 발생한 유전분증과 독성 장염이 합병되어 수술한 증례를 경험하여 보고하고자 한다.
증 례
67세 남자가 2011년 3월부터 정형외과에 입원하여 우측 인공관절의 패혈성 해리로 수술을 받은 이후 지속적으로 정맥항생제를 사용하며 간헐적인 설사로 치료하던 중 설사가 심해지고 열이 나 소화기내과로 협진이 의뢰되었다.
1996년 제2형 당뇨병을 진단받고 인슐린 치료 중이며, 5년 전 진단 받은 고혈압으로 경구 혈압 강하제 복용 중이고, 2002년 건강검진에서 우연히 발견된 전립선암으로 전립선제거술 시행 받았고, 2007년 전립선특이항원치 증가하여 방사선 치료를 시행받았다. 23년 전 교통사고로 인하여 양쪽 고관절 치환술 시행받았고 2007, 2008년 각각 우측과 좌측 재수술 시행받았으며, 2011년 3월 우측 골반의 장골근(iliacus muscle)의 농양 및 혈종으로 인한 세척과 괴사조직제거술 시행 후 간헐적인 경구 항생제를 반복 사용하였다. 2009년 간헐적 혈변으로 대장내시경 시행하였으나 비특이적 장염 소견 보였으며 조직검사에서도 만성 염증 소견 이외 특이소견이 없었다.
2011년 11월 소화기내과 협진 의뢰 당시 활력징후는 혈압 120/80 mmHg, 맥박수 분당 88회, 체온 37.8°C였으며 신체검사에서 만성 병색으로 안면이 창백하였고 호흡곤란 등의 특이소견은 보이지 않았으며 안결막의 빈혈이나 공막 황달은 없었고 혀는 경도의 건조상태를 보였다. 흉부 진찰에서 심음은 규칙적이고 심잡음은 들리지 않았으며 호흡음은 정상이었다. 복부는 팽만되어 있었으나 강직 등의 소견은 보이지 않았다. 장음은 다소 감소되어 있었으며 간이나 비장은 촉지되지 않았고 경도의 압통은 있었으나 반발통은 없었다. 전경골부에 함요부종은 관찰되지 않았다.
혈액검사에서 혈색소 10.1 g/dL, 백혈구 8,400/mm3(호중구 73.2%, 림프구 8.0%), 혈소판 270,000/mm3이었으며 적혈구 침강 속도는 36 mm/hr, C-반응단백 14.0 mg/dL이었다. 혈청 생화학 검사에서 AST 12 IU/L, ALT 2 IU/L, ALP 1,152 IU/L, 총단백 5.0 g/dL, 알부민 2.2g/dL, 콜레스테롤 86 mg/dL, 혈액요소질소 11 mg/dL, 크레아티닌 1.2 mg/dL, 칼슘 8.2 mg/dL, 인 2.7 mg/dL 이었다. 전해질은 나트륨 128 mEq/L, 칼륨 4.3 mEq/L였으며 일반 소견 검사에서 요단백 ++, 적혈구는 고배율 시야당 3~5개로 나타났다. HBsAg 음성, anti-HBs 양성, anti-HCV 음성이었고 대변배양검사에서 균은 동정되지 않았으나 C. difficile cytotoxin A/B 양성을 보였다.
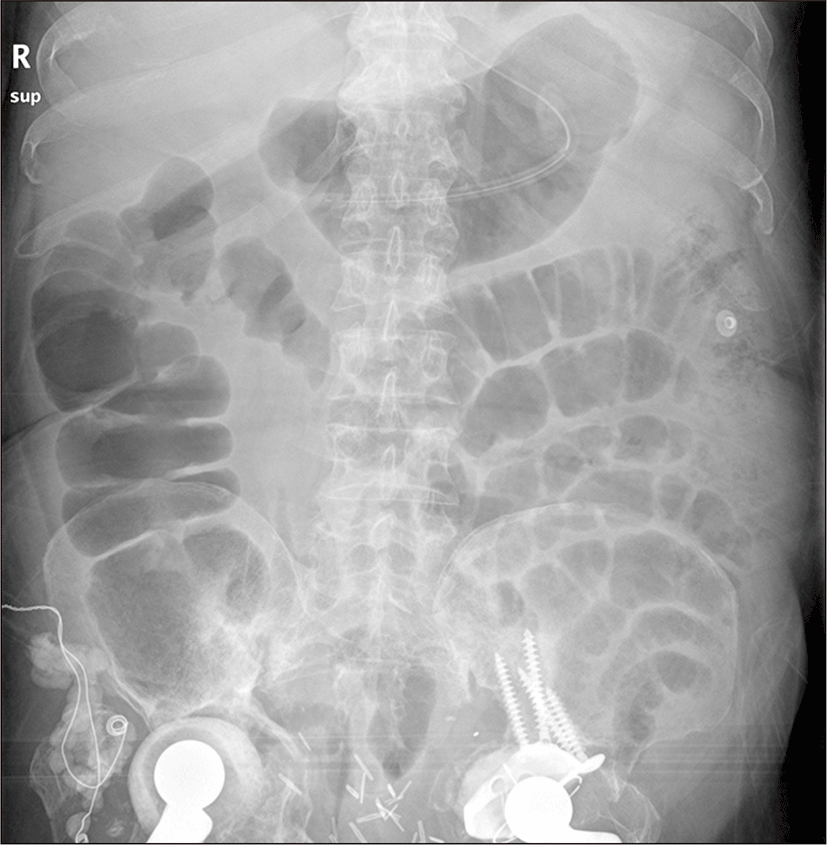
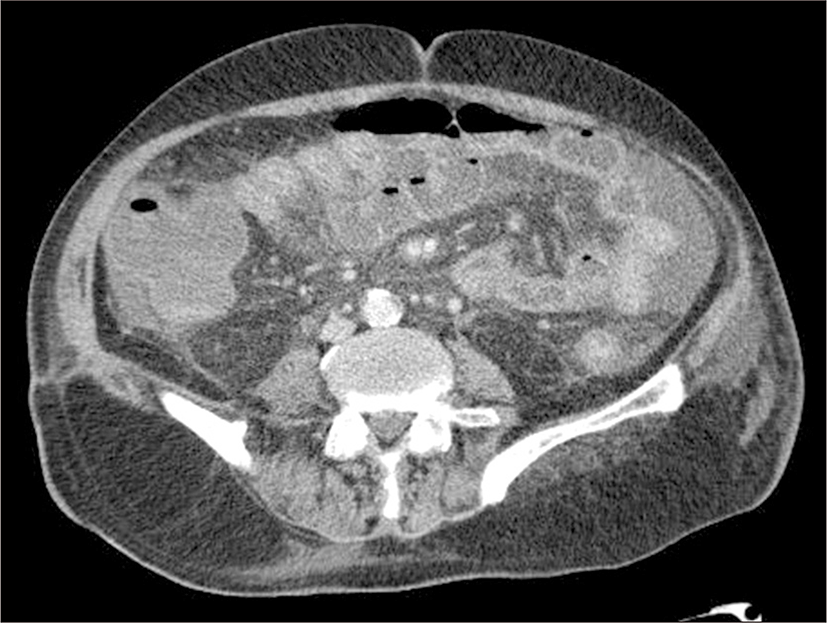
단순 복부 촬영에서 불응성 장마비 소견 보였고(Fig. 1), 복부 전산화 단층촬영상에서 횡행결장에서 직장까지 장관벽 부종으로 여러 겹으로 겹쳐져 비후된 모습을 보여 급성 염증성 장염에 합당한 소견이 관찰되었으며 복수나 종괴는 관찰되지 않았다(Fig. 2).
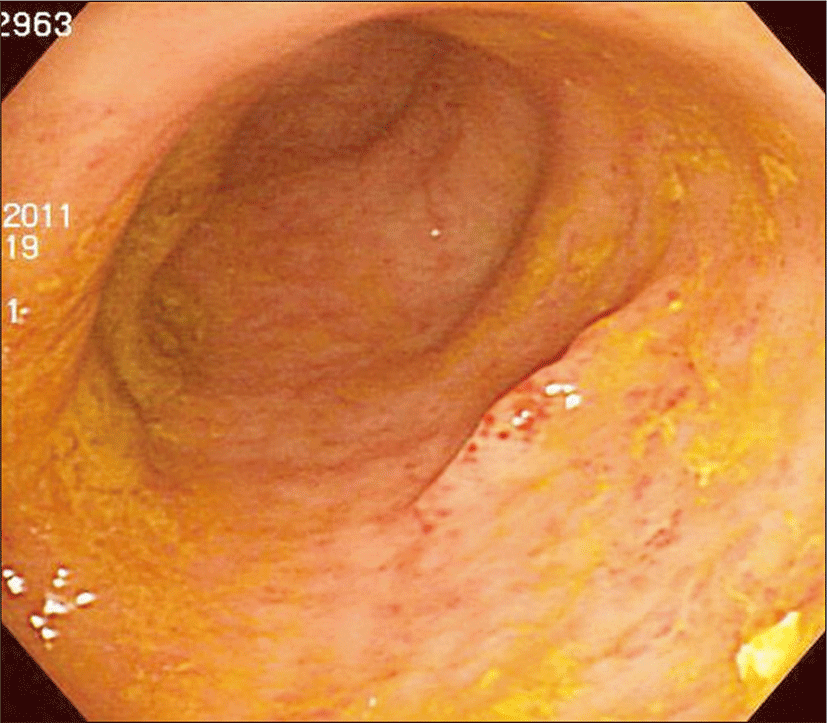
반복적인 설사로 인하여 입원 후 두 차례의 구불결장 내시경검사를 시행하였다. 증상 발생 초기에 시행한 구불결장 내시경에서는 전반적인 장점막의 부종과 발적이 관찰되었고 일부 흰색조의 삼출물이 붙어있는 미란이 관찰되어 의증 급성 장염, 의증 위막성 장염의 소견이 관찰되었다. 병변이 있는 장점막에 대하여 조직검사를 시행하였다(Fig. 3). 이후 반복적인 증상으로 1개월 후 구불결장 내시경검사를 다시 시행하였고 이전과 큰 변화 없는 상태로 직장점막의 조직검사를 다시 시행하였다.
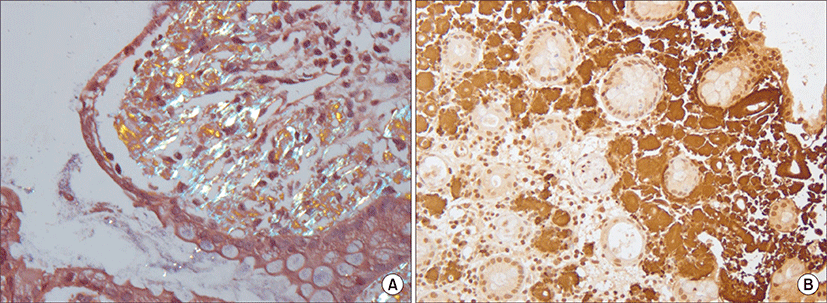
조직검사에서 고유근층에 무형성의 유리질(amorphous hyaline)이 침착되어 있는 만성 염증소견이 관찰되었고 congo red 염색에서 유리질화된 간질부위(hyalinized stromal area)에 이중 굴절 양성의 연녹색 물질이 침착된 양상을 보였으며 면역 조직화학 염색에서 AA형의 속발성 유전분증을 나타내었다(Fig. 4)
환자는 C. difficle 장염으로 인한 속발성 유전분증으로 진단되었고, 속발성 유전분증의 치료는 그 원인인 C. difficle 장염의 치료이기 때문에 경구 metronidazole 1.5 g을 복용하였고, 이후 설사량이 줄고 발열이 없어지며 증상이 호전되는듯 하였으나 복용시작 12일 후 증상이 다시 악화되는 소견을 보여 14일째 경구 vancomycin 1일 1 g과 정맥 metronidazole 1.5 g 병합요법으로 변경하였다. 변경 후 환자는 열이 소실되고 약 일주일간 설사 횟수가 2~3회로 감소하였으나 다시 설사가 악화되었고 복부 팽만이 진행되었다. 당시 시행한 단순복부촬영에서 불응성 장마비와 함께 횡행결장의 팽창소견을 보였고 38.5°C로 열이 나며 혈압 저하 소견을 보여 중환자실 치료를 시작하였다. 백혈구 11,100/μL (호중구 87.9%), C-반응단백 12.1 mg/dL로 염증 수치가 상승하여vancomycin 관장, budesonide 관장을 추가하였으나 증상 호전 보이지 않고 불응성 장마비와 복부 팽만 악화소견 보였다(Fig. 4). 상행결장이 8 cm가량 늘어나 독성 거대결장이 의심되어 전대장절제술 시행하였으나 수술시행 2일 후에 소변량 감소와 혈압 저하소견 보이며 다발성 장기부전으로 진행하였으며 수술 시행 3일 후 사망하였다.
고 찰
본 증례는 고관절 치환술 이후의 1년 이상 반복적인 항생제 치료로 인하여 C. difficile 장염이 발생하였고 내과적 치료에도 불구하고 치료되지 않고 있던 중 조직검사릍 통하여 속발성 유전분증으로 진단되었으며, 기저 질환인 C. difficile 장염이 호전되지 않으며 독성장염 및 패혈증으로 진행하여 전대장 절제술을 시행하였으나 호전을 보이지 않고 사망한 증례이다[2-5].
환자는 2002년 건강검진에서 전립섬암을 진단받고 수술 및 방사선 치료를 받았고 이후 2~3년 주기로 위내시경 및 대장내시경 시행 받은 환자로, 2009년 간헐적인 혈변으로 인하여 시행한 대장내시경 소견에서 비특이적 대장염 소견 이외의 특이소견 보이지 않았으며 조직검사에서도 만성염증 소견 보였다. 이후 2011년 3월 이후 반복적 정형외과 수술과 함께 항생제를 사용하면서 만성 설사가 악화와 호전을 반복하였고 9월 재수술 후 지속적인 항생제 사용으로 인하여 C. difficile 장염이 병발하였으며 대변검사를 통하여 진단되었다.
입원환자에서 항생제를 사용하면 약 5~25%에서 항생제와 관련된 설사를 경험하는 것으로 알려져 있고, 2003년 이후 C. difficile감염은 변이종의 전파에 의하여 사망률과 재발률이 높은 중증감염 양상을 보이고 있어 의심되는 환자에서 적극적인 치료를 하는 추세이며 본 환자의 경우도 초기부터 적극적인 약물치료를 시행하였다. 그러나 지속적인 항생제 치료에도 불구하고 C. difficile 장염의 호전은 보이지 않았으며 C. difficile 만성감염 상태에서 속발성으로 유전분증(AA)이 발생하였다.
위장관에 발생한 유전분증의 경우 흡수장애와 가성 장폐색 및 단백상실성 위장증을 유발한 증례가 있으나 C. difficile 장염에 속발된 유전분증의 경우는 드물다. Chang 등[10]은 햄스터를 통한 동물모델 연구에서 C. difficile 만성 감염이 유전분의 축적을 일으킨다고 보고한 바 있으나 인간에서 발생한 증례보고는 매우 드물며 기전 역시 명확하지 않다.
C. difficle 장염에 대한 일차 항생제 투여의 초기 반응률은 90% 이상이지만 치료 후 15~30% 환자들에서 재발을 경험하고, 초치료에 실패하는 빈도가 점차 증가하고 있으며 재발을 경험하는 환자의 약 0.4~3% 정도에서 독성장염으로 진행하는 것으로 알려져 있다[7]. 본 환자의 경우, 고령이며 동반질환이 있어 다른 환자의 경우보다 독성장염으로 이행할 가능성이 높은 환자였고 또한 이차적으로 유전분증이 발생한 경우로 이러한 합병증 발생의 위험도가 컸다.
속발성 유전분증 환자에서 전구 물질의 생산 감소, 유전분 검유물질의 축적과 생산 방해, 이미 존재하는 유전분 침착물의 제거와 융해를 촉진하기 위하여 일차성 유전분증에 준하는 치료를 시도하였으나 만족할 만한 성과가 없었고, 속발성 유전분증의 원인 치료로 유전분증이 자연적으로 소실되었다는 보고가 있는 만큼 C. difficle 장염의 치료가 본 환자에서 더욱 중요한 치료였다고 생각된다[8]. 이 증례의 경우는 지속적인 내과적 치료에도 불구하고 독성 장염이 합병되었는데 C. difficle 장염의 진행으로 인하여 발생하였을 가능성뿐만 아니라 유전분증 자체로 비정상적인 단백양 물질의 조직축적에 의하여 이차적으로 점막하 신경의 손상이 발생하여 장관의 운동성 저하에 의하여 나타났을 가능성도 있다[9,10].
C. difficle 장염에 독성 장염이 합병되는 환자의 경우, 약물치료와 수술적 치료로 크게 나눌 수 있으나 적절한 수술적 치료시기에 대해서는 정해진 바는 없다. 본 증례처럼 C. difficle 장염에 독성 장염이 합병된 경우 수술을 시행하는 것이 적절하며 그 외, 장천공, 복막염, 다발성 기관부전 등이 있는 경우 수술적 치료가 시행되고 있다. C. difficile 장염과 수술적 치료에 대한 연구에서 수술적 치료를 받은 경우 수술 당시 이미 다발성 장기부전이나 복막염 등의 전신적인 독성을 보인 환자에서 수술 치료가 이루어진 경우가 대부분으로 사망률이 35~80%로 매우 높았는데[11-13], 조기에 적절한 환자의 위험도 평가를 통하여 수술적 치료가 필요한 환자를 선별하는 것이 예후를 호전시키는데 도움이 될 수 있다.
따라서 본 증례와 같이 불응성 C. difficile 장염에 의해 이차성 유전분증이 발생한 경우, C. difficile 장염에 대한 적극적인 치료가 유전분증의 치료의 관건인 만큼, 약물 치료에 불응하는 경우 환자의 위험도 평가를 통하여 조기에 전대장절제술과 같은 수술적 치료를 고려할 필요가 있다.