서 론
2019년 12월 31일에 중국 후베이성 우한시에서 발생한 원인 미상의 집단 폐렴 환자들에 대하여 우한시가 처음 보고하였다. 초기에는 원인을 알 수 없는 신종 바이러스에 인한 것이 아닌가 혹은 중증급성호흡기증후군(severe acute respiratory syndrome, SARS)이 아닌가 추측이 있었다. 우한시에서 발표한 이후 우한시를 다녀온 홍콩과 대만, 싱가포르 사람들도 발열과 폐렴 증상을 보였으며, 점차 우한시 전역과 해외로 전파되기 시작하여 국내에서도 2020년 1월 20일 처음 해외에서 유입된 환자가 발생하였다[1,2].
전장 유전체 분석, 핵산 증폭, 바이러스 분리 등을 실시한 결과, 원인은 기존 SARS를 일으키는 코로나바이러스인 SARS coronavirus (SARS-CoV)나 중동호흡기중후군을 일으키는 Middle East respiratory syndrome coronavirus (MERS-CoV), 혹은 조류 인플루엔자 바이러스도 아닌 새로운 바이러스로 밝혀졌다[3]. 중국에서는 2020년 1월 13일에 이 원인 불명의 폐렴을 신종 코로나바이러스 감염에 의한 폐렴이라고 언급했으며, 1월 30일 세계보건기구(World Health Organization, WHO)에서는 2019 novel coronavirus (2019-nCoV)라는 임시명칭을 붙여 불렀다. 국제바이러스명명위원회에서 이 신종 바이러스가 2002년도 유행했던 SARS의 원인 바이러스였던 베타 속(genus) 코로나바이러스인 SARS-CoV와 구조가 유사하여 기존 SARS 바이러스는 SARS-CoV-1으로, 우한시에서 발생한 폐렴환자에서 발견된 바이러스는 SARS-CoV-2로 명칭을 제안하였다[4].
2020년 2월 11일에 WHO에서는 SARS-CoV-2에 의한 신종 감염증을 coronavirus disease-2019 (COVID-19)으로 명칭할 것을 권고하였다[4]. 우리나라에서는 현재 WHO에서 제안한 명칭에 따라 ‘코로나바이러스감염증-19’, 줄임말로 ‘코로나19’로 명명하여 사용하고 있다[1]. SARS-CoV-2는 SARS-CoV-1과 MERS-CoV에 이어 중증 폐렴을 일으키는 세 번째 유형의 코로나바이러스로, 현재 우리나라에서는 제1급 감염병 신종감염병 증후군으로 지정하여 대응하고 있다. 2020년 3월 WHO에서 COVID-19 세계적 대유행을 선언하였고, 현재 2021년 1월 기준 전 세계적으로는 8,500만 명이 누적 확진된 상황이며 사망자 수는 180만 명을 기록하였다[5]. 우리나라에서 현재까지 450만 건 이상의 검사를 실시하였고, 누적 확진자 수는 6만 명대인 상황이다[6].
바이러스에 감염된 환자를 조기 발견하는 것이 대응의 시작이라, 신속하고 정확한 검사를 통해 진단하는 것이 중요하다. 의료인이 아닌 일반인들조차도 코로나바이러스 검사 혹은 중합효소연쇄반응(polymerase chain reaction, PCR) 검사라는 말을 할 정도로 COVID-19 진단검사에 대한 인식은 대중화된 상황이다. 이에 본 논문에서는 COVID-19 방역에 큰 역할을 하고 있는 검사법, 특히 바이러스 핵산을 검출하는 분자진단법인 PCR 검사에 대한 이해를 돕기 위해 그동안 공개되었던 코로나 바이러스의 특성과 검사법을 연관지어 소개하고자 한다.
본 론
COVID-19 사태 이전까지 발견된 사람을 감염시키는 코로나바이러스는 여섯 종으로, 이 중에 네 종은 감기를 일으키는 비교적 흔한 바이러스다. 코로나바이러스 과(family)는 네 가지 분류로 나누어지는데, 각각 알파, 베타, 감마, 델타 속(genus)이다. COVID-19을 일으키는 SARS-CoV-2는 이중 베타코로나바이러스에 속한다. 베타코로나바이러스는 알파코로나바이러스와 함께 사람과 동물에 감염을 일으킨다. 사람에게 감염되는 코로나바이러스 여섯 종 중 human coronavirusC43, NL63, HKU 이들 네 종은 증상이 경한 상기도 감염의 원인 중 10–30%를 차지한다[7].
코로나바이러스에는 2002년 유행한 SARS 외에 2012년도에 중동지역에서 유행했던 MERS-CoV가 있으며, 이들 과거에 유행했던 코로나바이러스 감염증은 중증 폐렴을 일으키고, 전파력은 일부 국가에 한정되었다[8]. 그러나 이번 COVID-19 경우는 바이러스 전파양상이 과거 감염증 사태와 다르다. 우한시는 교통의 요지이며, 도시 인구밀도가 높아서 지역사회 감염이 더 확산됨과 함께 해외로 출국한 사람들을 통해 중국 다른 도시뿐만 아니라 최초 감염자 발견 이후 2개월 만에 수십 개 국가에 전파되었다.
SARS-CoV-2는 기존 유행했던 코로나바이러스와 잠복기, 전염력, 전파력에서 차이가 있으며, 임상증상 또한 다른 양상을 보인다. 증상이 없는 잠복기 상태는 평균 5–7일 사이로 추산되며, 정규분포 2.5–97.5 백분위수로는 잠복기 2–11일로 보고되었다[9]. 감염재생산지수(R0: 한 사람의 감염자가 직접 감염시키는 평균 인원수)는 SARS보다는 낮지만, MERS나 인플루엔자(계절성 독감)보다는 높은 2–2.5명으로 추정한다. 증상이 발병하기 2일 전부터 전염이 가능한데, 증상 발생 후 10일 이상 후에도 전염시킨 사례가 보고되었다[10]. 사망에 이르는 중증 폐렴부터 무증상이거나 아주 경미한 증상도 발생하는 등 임상양상이 다양한 것이 특징이다. 과거 코로나바이러스 감염증 사태보다 더 심각하게 전 세계에 전파되고 장기간 유행하는 것은 이런 SARS-CoV-2 특성에서 기인한 것으로 보인다.
SARS-CoV-2는 COVID-19 감염자가 내뿜는 비말을 통해 전파되어 사람의 코와 입을 통해 호흡기 점막세포와 구강세포로 전달되어 세포 내부로 침입한다[11]. 바이러스 내부의 RNA 게놈은 외피, 외막, 스파이크 등 주요 단백질에 둘러쌓여 있다가 풀려나 세포 내부에서 복제를 시작하여, 증식된 바이러스는 다른 호흡기 점막세포에도 칩입하여 호흡기 내부에 염증을 일으키고, 폐렴을 유발하게 된다[12]. 감염된 사람은 비인두 상피세포와 구인두 상피세포에 바이러스가 감염되어 있고 감염자의 침이나, 객담 내에도 바이러스에 감염된 상피세포가 존재한다.
우리나라 질병관리본부에서는 중국 푸단대학교에서 공개한 신종 바이러스에 대한 유전자 염기서열을 이용하여 SARS-CoV를 포함한 기존 여섯 종의 코로나바이러스에 대한 상동성 분석을 실시하여 SARS-CoV와 상동성이 77%, MERS-CoV 55%, 사람코로나바이러스 39–43%임을 확인하고 PCR 검사법 개발을 추진한다고 국내 첫 환자 발생 전인 2020년 1월 13일에 발표하였다[13]. 초기 PCR 검사는 일차로 전체 종류의 코로나바이러스에 대한 검사인 판코로나바이러스 검사를 통해 코로나바이러스 검출 여부를 확인하고, 일차검사에서 양성이면 이차로 SARS-CoV-2의 특정 유전자에 대한 PCR 검사를 진행했다. 미국 질병통제예방센터(Centers for Disease Control and Prevention, CDC)에서 유전체 정보를 제공했고, 우리나라 질병관리본부에서 COVID-19 환자 양성검체 획득 및 정도관리 물질을 제작했다. 국내 COVID-19 첫 환자가 보고되고 확산이 우려되는 가운데, 이에 적절하게 대응하기 위해서는 병원과 같은 민간기관에서 COVID-19 진단검사 역량을 확대해야 하는 상황에서 정부기관과 대한진단검사의학회 등 학계, 진단시약 제조사 및 민간 의료기관이 긴밀하게 협조하며 발빠르게 대응했다. 질병관리본부에서 긴급사용 승인평가 공고를 낸 이후 민간 진단시약 업체들도 일선 검사실에서 쉽게 검사할 수 있고 검사가 수시간 내로 끝나는 상용화된 진단시약 개발을 2020년 2월에 완료하였다.
‘긴급사용 승인제도’는 감염병 유행이 우려되어 긴급하게 검사 진단시약이 필요한 경우, 아직 허가된 제품이 없는 경우에 식품의약품안전처 승인 하에 한시적으로 신속한 평가 및 심의를 진행하는 제도다. 승인 후에도 지속적 질 관리와 함께 환자검체 수집을 통해 교차분석을 하여 검사성능평가가 필요하고 차후에 정식 제조허가를 받아야 한다.
국내 긴급사용 승인을 받아 시행되는 SARS-CoV-2 PCR 검사법은 임상적 민감도가 통상적으로 95% 이상으로 알려져 있다. 임상적 민감도는 질환을 가지고 있는 사람 중 검사결과가 양성으로 검출되는 비율을 말하는데, PCR 검사의 민감도가 높으면 위음성이 나올 확률이 적다는 의미다. 우리나라에서 COVID-19의 진단목적으로 허가된 검사는 PCR 검사로, PCR보다 민감도 및 특이도가 떨어지는 항원이나 항체를 이용한 면역검사들은 진단을 목적으로 한 검사는 아니다. PCR 검사는 간단히 설명하자면, 분자진단 기법의 한가지로, DNA나 RNA와 같은 핵산이라는 유전체 물질을 대상으로 목표로 한 유전자를 검출하는 검사법이다. 코로나바이러스의 경우에는 RNA 형태로 유전자 염기서열을 저장하고 있는데, 이번에 발견된 SARS-CoV-2에서만 발견되는 특정 유전자들을 목표로 하여 해당 유전자의 일부 부위를 증폭시켜서 검출이 가능하게 한다.
우리나라에서는 WHO에서 초기에 권고한 가이드라인에 따라 SARS-CoV-2의 특정 유전자인 RNA-dependent RNA polymerase (RdRp)와 envelope (E) 유전자를 대상으로 PCR 검사시약이 개발되어, 2020년 2월과 3월에 긴급사용승인을 받았던 다섯 개 회사들의 제품이 출시되었다[14]. 이후 자문을 거쳐 ORF1ab 유전자의 일부 구역인 RdRp뿐만 아니라, ORF1ab 옆에 위치한 ORF1a 유전자도 검사부위로 승인되었으며, N 유전자도 검사부위로 승인되어 사용되고 있다. 국내회사의 PCR 키트와 미국회사의 PCR 키트에서 유전자 구성의 차이는 크지 않으며, 알려진 유전자 중에서 두 개 혹은 세 개 정도를 고르는 게 대부분이다. 코로나 사태 초창기에는 특정 유전자 부위가 반드시 포함되어야 한다고 하였으나, 현재는 특정 유전자 부위와는 상관없이 두 개 이상 다수의 유전자 부위가 포함된 시약이면 문제가 없으며, 검사의 성능평가 후 민감도 및 특이도 등을 만족하면 식품의약품안전처의 심사 후 허가를 받아 국내에 제품출시 혹은 수출허가를 받을 수 있다.
초기 출시된 긴급사용 승인된 PCR 검사시약으로 2월 4일 PowerChek 2019-nCoV Real-time PCR (KogeneBiotech, Seoul, Korea) 제품을 시작으로, Allplex 2019-nCoV (Seegene, Seoul, Korea), DiaPlexQ Novel Coronavirus (2019-nCoV) Detection (SolGent, Daejeon, Korea) 및 STANDARD M nCoV Real-Time Detection (SD BIOSENSOR, Osong, Korea) 제품들이 2월 중에 허가되었고 이후 3월에 Real-Q 2019-nCoV Detection (BioSewoom, Seoul, Korea) 및 5월에 BioCore 2019-nCoV Real Time PCR (BioCore, Seoul, Korea)과 careGENE N-CoV RT-PCR (Wells Bio, Seoul, Korea) 시약들도 추가로 허가받았다[14] (Table 1). 이들 PCR 검사들은 검체 전 처리, 핵산추출부터 PCR 시약 주입, PCR 과정까지 일련의 과정이 필요하며 1회 검사에 최소한 4시간에서 6시간은 필요하다.
2020년 8월에는 기존 PCR 검사들보다 신속하게 분자진단이 가능한 응급용 PCR 검사가 승인되어 일선 검사실에서 사용 가능하게 되었다(Table 1). 해외에서 출시된 GeneXpert 장비와 전용 카트리지를 이용한 PCR 검사 Xpert Xpress SARS-CoV-2 (Cepheid, Sunnyvale, CA, USA)와 함께, FilmArray PCR 검사 BioFire Respiratory Panel 2.1 (bioMerieux, Marcy l'Etoile, France)는 핵산추출과정 및 시약주입 등 시간이 소요되는 PCR 전 단계 과정이 생략되어 검사과정이 보다 단순하다. 그외에도 국내회사에서 개발하여, 핵산추출과정이 생략되었거나, 혹은 핵산추출과정은 필요하지만 시약 전 처리 및 PCR 과정까지 1시간 이내로 아주 단축된 검사들이 출시되었다. 회사에서 개발한 전용장비를 사용하여, 작은 공간 혹은 야외 선별진료소에서 직접 검사가 가능한 제품도 있다. 코로나 감염사태가 장기화됨에 따라 향후 이런 응급용 PCR 검사들이 널리 활용될 것으로 보인다.
1) Real-time 역전사 PCR 검사
현재 CDC 홈페이지에서 리스트업하는 SARS-CoV-2 PCR검사키트는 수십 가지 종류가 있는데, 우리나라에서 개발한 PCR 키트나 해외업체의 PCR 키트나 증폭하려는 SARS-CoV-2 특이 유전자 구성에서는 큰 차이가 없다. PCR 원리를 이용한 유전자검사법은 real-time PCR 장비를 이용한 것으로, SARS-CoV-2가 RNA 바이러스이므로, 원하는 특정 유전자(예: E, RdRp, nucleocapsid [N])를 역전사 중합효소(reverse transcriptase, RT)를 이용하여 역전사시켜 RNA 형태에서 cDNA로 만든 뒤 증폭시킨다. 검출 민감도가 높으나 전문 검사실에서 전문인력이 몇 시간 동안 검사과정을 거쳐 최종 판독을 마쳐야 양성, 음성 결과로 보고할 수 있다. 우리나라에서는 2020년 상반기까지 이 PCR 검사만 진단목적으로 시행해 왔는데, 2020년 하반기부터는 생명이 위독한 환자나 응급수술이 필요한 환자에서 빠른 처치를 위해 COVID-19을 배제하려는 목적으로 1–2시간 내로 PCR 검사가 완료되는 응급 PCR 검사가 허가되면서 구분을 위해 진단 목적의 PCR 검사를 확진 PCR 검사라 명칭하기도 한다(Table 2).
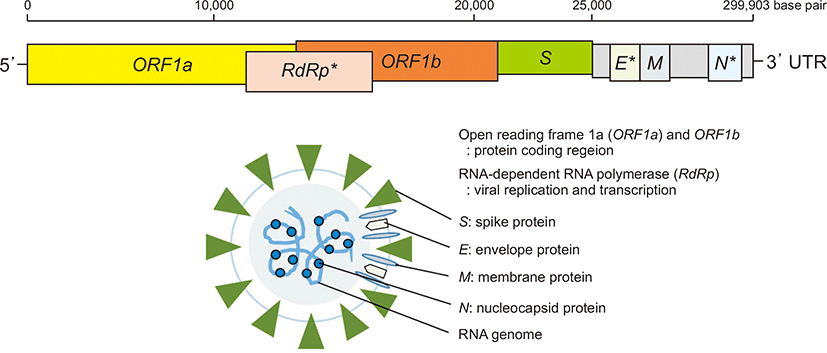
상당수 SARS-CoV-2 PCR 키트에서 모든 베타코로나바이러스에서 검출되는 E 유전자를 포함하는데, E 유전자에서 최종적으로 만들어내는 외피 단백질이라고 해서 왕관모양의 코로나바이러스 형태의 외피를 구성한다(Fig. 1). WHO에서 코로나 발생 초창기에 확진 검사 목적으로 권고했던 RdRp 유전자는 대표적인 SARS-CoV-2 특이 유전자인데, 기본적인 역할은 바이러스 RNA를 복제하는 효소를 만들어내는 유전자다. RdRp 유전자 부위를 포함하는 좀더 넓은 범위의 유전자를 ORF1ab 유전자라고 하며, 일부분인 RdRp 혹은 ORF1ab를 대부분 PCR 시약제품에서 포함시키고 있으며 SARS-CoV-2에 특이적인 RdRp 염기서열만 증폭하도록 제작되었다[15]. SARS-CoV-2에 특이적인 N 유전자도 몇몇 시약에서 포함하는데, N 유전자가 만들어내는 뉴클레오캡시드 단백질(nucleocapsid protein)은 RNA 게놈에 결합하여 복합체인 뉴클레오캡시드를 형성한다(Fig. 1).
구형 표면에 박혀 있는 곤봉형태의 스파이크 단백질(spike protein)은 S 유전자에서 만들어지며, 그 외 membrane (M) 유전자나 ORF1a, ORF1b 유전자에서도 SARS-CoV-2 특이적인 염기서열을 증폭하도록 제작된 제품들이 있다. SARS-CoV-2 PCR 검사시약 제작 시 SARS-CoV-2에 특이적인 염기서열과 해당 유전자를 검출하도록 primer를 만들어 제작했기 때문에 다른 호흡기바이러스나 감기를 주로 일으키는 human coronavirus 229E 혹은 OC43에 감염된 환자에서 검사해도 검사결과는 음성으로 나오게 된다.
2020년 11월 19일부터는 기존 SARS-CoV-2에 특이적 유전자들뿐만 아니라 인플루엔자 바이러스 감염여부를 확인할 수 있는 유전자인 인플루엔자 A 바이러스의 M 유전자와 인플루엔자 B 바이러스의 NP 유전자가 추가되어 동시검사가 가능한 real-time RT-PCR 시약 또한 사용허가를 받아 일선 병원과 검사기관에서 사용가능하게 되었다[10]. 겨울에 유행하는 인플루엔자 바이러스 감염 시 COVID-19와 유사한 임상증상을 보여 검사를 통해 감별이 필요한데, 동시검사를 시행할 경우 검사 한번에 두 질환을 동시에 배제할 수 있다.
2) 혼합 검체 검사
PCR 검사는 극소량의 핵산도 증폭시켜서 검출이 가능하여, 몇 명분의 검체를 혼합하여 한 검체로 만들어 검사하여도 COVID-19 감염자의 검체가 혼합되어 있는 경우에는 양성 결과를 보인다. 어떤 검체에서 양성이었는지 이차 단계로 모든 개별 검체를 각각 검사하여 양성 검체를 찾아낼 수 있다. 현재 혼합 검체 검사(취합 검사/풀링 검사)는 상기도 검체 5–6개 이하로 혼합할 것을 권장하고 있다[14]. 동일한 검사시간에 적은 비용으로 한 번에 많은 검체를 검사하여 COVID-19을 배제시킬 수 있어서 병원 입원을 앞두고 있는 환자그룹, 군부대, 요양시설 등 집단생활을 하는 무증상자 그룹에서 전수검사를 하는 목적으로 허가되었으며, 건강보험 적용 및 진단검사비가 한시적으로 지원되고 있다.
3) 신속분자검사법(응급용 PCR 검사)
민감도가 가장 높은 확진 검사는 반나절 후에나 결과를 확인할 수 있는 반면, 보다 신속하게 1–2시간 뒤 결과보고가 가능한 신속분자검사법이 개발되었다(Table 2). 확진 검사와 동일하게 SARS-CoV-2 특이적인 유전자를 검출하는 분자진단검사로, RT-PCR을 이용한 검사법이다.
미국에서는 COVID-19 유행 초기부터 Cepheid사에서 개발한 전용 PCR 장비인 GeneXpert에 장착하여 검사가 가능한 카트리지 형태의 PCR 검사를 도입했으며, 우리나라에서도 국내 업체들이 과정을 단순화하고 1시간 내로 보고 가능하면서 기존 real-time PCR 장비를 이용가능한 PCR 시약을 출시하였고, 응급검사 전용 PCR 장비들을 이용하게 한 제품들도 있다. 일선 병원에서 널리 이용하고 있는 GeneXpert 장비는, 단순하게 환자 검체를 시약이 포함되어 있는 카트리지에 주입하고 장비에 장착하면 핵산추출부터 PCR 과정이 연속적으로 진행되어 1시간 이내에 검사결과를 확인할 수 있다. 장비 내에서 검체전처리와 PCR 과정을 진행하므로 숙련된 전문 검사인력이 아니어도 검사가 가능하다는 장점이 있다. 그러나 검사 민감도가 앞서 기술한 확진 검사보다는 약간 떨어질 수 있어서, 바이러스 농도가 낮은 환자에서는 위음성 결과의 가능성이 있다. 수입제품의 경우에는 전용 카트리지 가격이 상대적으로 비싸고 공급이 원활하지 않은 상태이며, 우리나라의 진단검사 보험수가 체계 하에서는 응급수술이 필요한 환자나 생명이 위급한 환자들에서만 급여검사로 의뢰가 가능하다는 제한점이 있다. 현재 우리나라에서는 COVID-19로 의심되지 않는 환자에서만 이런 응급용 PCR 검사 의뢰가 가능하며, COVID-19가 의심되는 경우에는 민감도가 높은 확진 검사를 의뢰해야 한다. 향후 COVID-19 상황에 따라, 시약 공급이 원활해지면, COVID-19 의심 환자에서도 빠른 진단과 치료를 위해 응급용 PCR을 시행해야 할 것으로 보인다.
4) 항원 검사
PCR 검사법은 세포내부에 존재하는 바이러스 핵산인 RNA를 직접 추출하여 증폭하는 방식으로 감염여부를 확인하는 방식이다. 반면에 항원 검사는 바이러스 RNA를 탐지하는 방식이 아닌, 바이러스를 구성하는 특정 단백질인 뉴클레오캡시드 항원(nucleocapsid antigen)을 검출하는 방식이다(Table 2). 항원 검사나 항체 검사는 검사결과가 15–30분 정도로 빨리 나오며, 검사키트 비용도 저렴하지만, COVID-19 감염에 대한 민감도가 PCR 검사보다 떨어지며, 다른 호흡기바이러스 환자에서 교차반응을 일으켜 위양성 결과가 나올 수 있다(Table 2). 국내에서 승인된 항원검사 키트의 성능평가 결과, PCR 검사 대비 임상적 민감도는 41.5%로 추정되었고, 바이러스 양이 적은 환자에서는 위음성 결과가 80% 이상이었다(cycle threshold [Ct] 값 23.37 이후 검체에서 항원검사의 민감도 11%) [16]. 항원 검사의 낮은 민감도와 특이도 및 국내 낮은 유병률(2020년 11월 30일 기준 0.06%)을 고려하면 국내에서는 급성기 진단 또는 선별 목적으로 사용하기는 어렵다[14]. 우리나라에서는 PCR 검사가 감염여부 확진 목적으로 허가되어 있고, 항원 검사는 정확도는 부족하나 신속하게 결과를 내주므로 감염 진단에 보조적인 목적으로 허가되었다.
5) 항체 검사
항체 검사는 감염자의 림프구가 생산한 항 SARS-CoV-2 항체가 IgM 항체와 IgG 항체 각각 별도로 검출이 가능하다. 항체 검사는 기존 감염자에서 검사할 경우, 질환에서 회복된 후 몇 달이 지난 뒤에도 체내에 항체가 존재하므로 항체 양성 결과가 나온다. 항체 검사 단독으로는 SARS-CoV-2에 면역반응이 나타났다는 것만 알 수 있으므로, 현재 바이러스가 존재하는지 여부는 알 수 없어서 감염 진단 목적으로는 부적합하고, 과거에 감염 이력이 있었는지 확인할 수 있다. 항체 검사는 해외입국 시 항체 검사 결과를 제출하는 용도로 비급여 검사로 처방 가능하며, 집단 감염력을 조사하는데 이용할 수 있다.
검사를 위해서는 코와 입을 통해 채취봉으로 점막을 긁어 채취하거나 객담을 받아 채취한다. 상기도 검체와 하기도 검체를 동시에 검사할 것을 추천하며, 상기도 검체로는 비인두도말, 구인두도말, 하기도 검체로는 객담, 기관지흡인, 기관지폐포세척액 등의 검체가 있다[17]. 일반적으로 이용하는 검체 채취용 면봉은 비인두도말과 구인두도말을 각각 채취하여 하나의 universal transport medium 용기에 넣어서 뚜껑을 닫아 검사실로 보낸다.
검체 채취용 면봉에는 상피세포를 많이 채취할 수 있게 나일론 섬유가 솔처럼 촘촘히 박혀 제작되어 있다[18]. 바이러스성 호흡기 감염을 진단하기 위해 PCR 검사의 검출 민감도를 높이려면 많은 상피세포를 얻어 바이러스 핵산을 추출해야 한다.
객담 검체가 제대로 채취된 경우, PCR 검사결과의 Ct 값은 일반적으로 객담 검체가 비인두 상기도 검체보다 낮은 수치를 보인다[19]. 즉, 바이러스 농도가 보다 높게 검출되었다는 의미이다. 검사 받는 사람이 객담을 제대로 깊이 기침하여 화농성 객담을 채취해야 하는데, 이렇게 채취되지 않았거나 검사 전 처리 과정에서 phosphate-buffered saline을 많이 넣어 희석할 경우 객담의 PCR 결과 Ct 값이 상기도 검체 Ct 값보다 더 높은 경우도 있다. COVID-19 진단검사 시 권고사항은 상기도와 하기도 검체를 동시에 검사하는 것이지만, 각각 검사를 해야 하므로 검사비용이 두 배로 든다는 부담이 있고, 많은 인원을 제한된 시간 내에 채취해야 하는 선별진료소 상황을 고려해야 하며, 객담 채취과정에서 COVID-19 감염자가 기침하는 경우 바이러스가 주변으로 전파될 위험성이 있으므로, 대부분 상기도 검체만 채취하여 검사하고 있다. 하나의 검체만 채취해야 한다면 상기도 검체만 채취하도록 권고하고 있다[17,20].
바이러스 RNA를 환자 검체로부터 추출하기 위해 상업화된 핵산 추출 키트를 이용한다. 또한 각 회사의 핵산 추출 키트에 특화된 자동화된 전용 장비를 이용한다. 자동화된 장비를 이용할 경우, 핵산추출 과정은 환자 검체를 피펫(pipette)을 이용하여 취할 때부터 장비에 넣고 최종적으로 핵산추출이 완료될 때까지 2시간 정도 시간이 소요되고 장비에 따라 검체 수가 많은 경우 더 오랜 시간이 소요될 수 있다.
핵산추출부터 시작하여 시약 분주, PCR 증폭까지 일련의 과정에서 환자의 상기도, 하기도 검체뿐만 아니라 양성대조물질, 음성대조물질을 추가하여 같이 검사를 시행한다. 양성대조물질은 양성 결과를 보여야 하며, 음성대조물질은 음성 결과를 보여야한다. 예를 들어, 양성대조물질에서 예상치 못하게 음성 결과가 나온다면, 해당 검사에 속했던 환자 검체의 결과는 모두 부적합 결과로 판단하고, 모두 재검사를 실시해야 한다[20].
핵산추출부터 PCR까지 이어지는 일련의 검사과정은 최소한 5–6시간, 한 번에 다루는 검체가 많은 경우는 그보다 더 많은 검사시간이 소요된다. 또한 부적합 결과 등의 이유로 재검사도 빈번하게 발생한다. 하루에 한 번만 PCR 검사를 수행하는 기관의 경우에는 재검을 할 경우 최종보고까지 검체 채취 이후 2–3일이 걸릴 수도 있는 과정이다.
민감도가 가장 높은 확진 검사는 정확한 검사결과를 위해서 많은 시간이 소요되는 검사다. 자동화 장비로 수행하는 기본 혈액검사들처럼 검체 채취 후 당일에 몇 시간 내로 보고할 수 있는 검사로 생각하면 안되며, 숙련된 검사자가 여러 명 있어야 하고 최종 결과를 진단검사의학과 전문의가 판독해야 하는 검사다. 따라서 검사에 필요한 인력이 충분하지 않은 기관에서는 기관 내 검사로 세팅하여 유지하기 어렵고, 외부 위탁기관으로 보내어 검사하는 실정이다.
CDC 기준에 따르면 SARS-CoV-2 PCR 키트는 최소 두 개의 유전자를 포함하고 있어야 하며, 양성 음성 판정 시에는 표적 유전자에서 기준으로 정한 Ct 값을 토대로 판정한다. E, RdRp, N과 같은 표적 유전자 두 개 혹은 세 개 유전자가 양성 기준으로 정한 Ct 값 이하로 동시에 검출되면, 양성으로 판정하고, 둘 다 증폭되지 않으면 음성으로 판정하게 된다[20]. 예를 들면 E 유전자 Ct 값 36 이하, RdRp 유전자 Ct 값 36 이하를 기준으로 제작한 PCR 검사 키트를 사용하여 검사했는데 E 와 RdRp 둘 다 Ct 값 20–30 정도로 결과가 나온 경우 SARS-CoV-2 PCR 결과 양성으로 보고 할 수 있다.
검사 과정에서 PCR 반응이 제대로 일어났는지 확인하기 위해 내부대조물질을 개별 환자 검체 튜브에 주입하여 내부대조물질을 증폭한 결과가 기준 Ct 값 이하로 나와야 해당 검체에서 PCR 반응이 제대로 되었다고 판단하게 된다[21]. 핵산추출 단계 전에 별도로 내부정도관리 물질을 주입하기도 하며, 핵산추출 후 단계에서 PCR mixture에 주입하는 검사 키트도 있다. 모든 SARS-CoV-2 PCR 검사 키트에는 내부대조물질이 제공되는데, bacteriophage, recombinant DNA plasmid, pseudovirus particle 등의 물질을 활용하고 있다. 내부대조물질을 human RNase P 유전자, human β-globin 유전자와 같은 사람 유전자를 사용하고 있어 별도로 첨가하지 않는 검사 키트도 있다[21,22].
COVID-19 감염된 사람의 검체로 PCR 검사 시, 형광물질의 증폭 곡선이 기준이 되는 40 cycles 혹은 36 cycles 이하에서 증폭이 되는 것을 관찰할 수 있다. 코로나바이러스를 구성하는 RNA 유전체의 특정 유전자 부분을 표적으로 한 primer와 probe를 환자 검체에 섞고 PCR 장비에 넣어 PCR 원리를 이용하여 증폭시킨다. PCR의 3단계인 1단계 denaturation, 2단계 primer annealing, 마지막 단계인 extension에서 probe에 붙어있던 형광물질이 떨어져 나가면서 발현되어 실시간으로 측정하여 증폭곡선을 그려낸다. 표적 유전자별로 다른 형광물질을 붙였기 때문에 동시에 내부대조물질 그래프를 포함하여 코로나바이러스 특이적인 두 개 혹은 세 개의 유전자의 그래프를 동시에 그릴 수 있다. 예를 들면 RdRp 유전자에는 Cal Red 610 형광물질을, N 유전자에는 Quasar 670 형광, E 유전자에는 FAM 형광, 내부대조물질에는 HEX 형광을 붙이는 식이다.
대략 1시간 30분에서 2시간 동안 진행되는 PCR 과정에서 총 40–50번 cycle까지 수행되는데, 중간에 형광 신호가 검출되는 역치를 넘는 순간의 cycle을 Ct 값이라고 한다. 환자가 감염된 지 얼마 되지 않아 검체에 들어있던 바이러스의 농도가 높은 경우에는 PCR 과정에서 초반에 10번 혹은 20번 cycle에서도 역치를 넘었을 것이고, 이 경우 10 혹은 20 정도의 낮은 Ct 값을 보인다. COVID-19 확진자로 판정된 후 치료를 받거나 무증상 감염 상태에서 시간이 흐름에 따라 바이러스 농도는 서서히 감소하지만, 매우 민감하고 감염력을 잃은 바이러스까지 검출하는 확진 PCR 검사로는 30 이상의 높은 Ct 값을 보이며 검출되는 경우가 많다. 특히, 초기 감염 시 체내 바이러스 농도가 아주 높았고, 폐렴 등 중증 상태의 환자였던 경우에 바이러스는 상당 시간 동안 검출된다. Ct 값이 30 이상으로 높으면 응급용 PCR 검사에서는 검출이 불가한 경우가 있다.
간혹 환자 검체에서 베타코로나바이러스 공통 유전자(E)와 SARS-CoV-2에서만 검출되는 RdRp, N 중 일부의 유전자만 양성인 미결정 결과를 보일 수 있다. 코로나 사태가 장기화된 최근에 들어서는 환자가 확진자였음을 밝히지 않았거나, 병력청취 과정에서 제대로 확인이 되지 않았던 경우도 있어 초진 환자가 아닐 가능성도 생각해야 한다. 확진자가 치료를 받고 회복한 후에, 학교나 직장 복귀를 위해 후속 검사를 하는 경우가 있는데, PCR 검사를 해보면 E, RdRp, N 유전자 중 하나만 약하게 양성인 경우가 있으며, 음성이었다가 약하게 양성 결과를 보이는 경우도 대략 20%의 예에서 발생한다고 보고된 바 있다[23]. 이러한 현상을 바이러스 반동이라고 표현한다.
과거 COVID-19 확진자가 아닌 경우에서 PCR 검사 상 유전자별 양성 및 음성이 엇갈리는 결과가 나오면 재검사를 실시하게 된다[20]. 예를 들어, 공통 유전자 E만 양성이고 나머지 유전자들은 음성인 경우가 반복적인 검사에도 나올 수 있다. 초진 환자에서 E 양성인데 RdRp와 N 음성인 경우에는 2003년도에 중국과 홍콩에서 유행했던 SARS-CoV-1 (박쥐유래 SARS-like 베타코로나바이러스, sarbecovirus)이거나 혹은 해당 PCR 검사 민감도의 한계로 다른 RdRp이나 N 유전자에서는 위음성결과가 나왔을 가능성, 또는 E 유전자 단독 튜브로 검사하는 방식의 검사키트에서는 양성대조물질 및 양성검체와 교차오염 가능성이 있다. 현재에는 SARS-CoV-1 감염증이 다시 출현했다는 증거가 없고, sarbecovirus가 아닌 OC43, HKU1과 같은 일반적인 감기를 일으키는 베타코로나바이러스는 E 유전자가 없어서 증폭되지 않는다. 따라서 E 단독 양성인 결과에서는 검사자체의 민감도 한계 및 과정 상 오염을 우선 생각해야 하고, 핵산 재추출부터 시작하여 재검해야 한다[21].
결 론
본 논문에서는 COVID-19 방역에 큰 역할을 하고 있는 진단검사, 특히 real-time RT-PCR을 이용한 유전자검사에 대한 이해를 돕기 위해 그동안 밝혀진 SARS-CoV-2에 대한 이해와 함께 국내 검사실에서 실시 중인 검사법들을 소개하였다. 현재 국내에서 COVID-19 진단목적으로는 성능이 입증된 real-time RT-PCR 검사를 권고하며, 본 검사는 전용장비와 시약, 전문인력이 필요하고 판독을 거쳐 최종 결과보고까지는 수 시간 정도 시간이 소요된다. 응급용 PCR 검사는 신속하게 결과를 확인할 수 있고 검사과정이 간단하다는 장점이 있는 검사이지만, 시약 공급이 원활하지 않아 국내에서는 제한적으로 사용되고 있다. 항원 검사는 PCR 검사가 어려운 환경에서 COVID-19 진단에 보조적인 수단으로 사용 가능하다. 전 세계적인 유행이 현재 진행 중인 상황에서, 검사지침과 권고사항은 COVID-19의 과학적 근거와 경험이 축적됨에 따라 달라질 수 있으며 유행 상황에 맞게 지속적으로 업데이트될 것이다.