서 론
간이식은 1963년 Starzl 등[1]에 의해 미국에서 처음 시도된 이래 간부전 환자의 표준적인 치료로 자리 잡았다. 내과적 치료가 불가능하며 사망률이 대단히 높은 전격성 간부전, 간성혼수, 간신증후군, 간폐증후군, 문맥폐동맥고혈압 등의 환자들은 간이식으로 궁극적으로 치료할 수 있다고 알려져 있다. 따라서 성공적인 간이식 마취를 위해서는 말기 간질환 환자의 병태생리와 수술술기를 잘 이해하고 마취에 임해야 한다.
간이식 수술은 이식 중에서도 어렵고 복잡한 술기를 필요로 하며 술 중 혈역학적 불안정성이 크고 수술 후 치명적 합병증 발생률이 높아 이에 따른 사망률 또한 높은 수술이다. 국내에서는 1988년 최초로 윌슨병 환자에서 뇌사자 간이식을 성공하였고[2], 2000년 2월 국립장기이식관리센터가 생긴 이후 2015년까지의 통계자료를 살펴보면 국내 53개 병원에서 간이식이 시행되었으며, 2015년 국내 38개 병원에서만 간이식이 시행되었다[3]. 소규모 센터인 이대목동병원은 2013년 한국장기기증원과 협약을 체결하고 간이식센터를 개소, 2013년 4월 첫 간이식을 성공적으로 시행하였고 2013년 9월부터 뇌사판정 대상자 관리 전문기관으로 지정되어 뇌사장기기증 증진 프로그램에 등록되었다.
간이식 수술은 준비단계에서부터 외과와 마취통증의학과를 비롯하여 소화기내과, 감염내과, 순환기내과, 호흡기내과, 정신건강의학과, 치과, 진단검사의학과, 영상의학과, 핵의학과, 병리과와 영양지원팀 등을 포함한 여러 과의 다학제 간의 긴밀한 협조가 필요하다. 우리나라의 경우, 현재 지금은 대규모센터에서 대부분의 간이식이 행해지고 있는 실정이지만, 새롭게 시작하는 소규모 센터들의 도전이 계속되고 있다. 본원에서는 2013년 4월 생체 간이식을 시작으로 간이식을 성공적으로 시행하고 있기에 간이식을 새로 시작하는 병원에서의 마취의 초기경험을 문헌고찰과 함께 보고하고자 한다.
방 법
본 연구는 2013년 4월부터 2017년 4월까지 4년간 본원에서 생체 및 뇌사자 간이식을 시행 받은 환자들을 대상으로 의무기록을 통해 후향적 분석을 하였다. 전신마취 하 간이식을 받은 환자들의 나이, 성별, 미국마취과학회 신체등급분류, 동반질환과 수술 전 영상자료, Model for End-stage Liver Disease (MELD) score를 분석하고, 수술 및 마취시간, 수술 중 소요된 무간전기, 무간기, 재관류기 시간, 냉온허혈시간, 출혈량과 수혈량 등을 조사하였다. 또한 수술 후 합병증에 대해서도 의무기록을 토대로 뇌사자 이식군과 생체 이식군으로 나누어 비교분석하였다.
본원에서는 간이식 마취를 시작하기 전 마취통증의학과 의사를 비롯한 간이식 관련 의료진이 다년간 간이식을 수행하고 있는 대규모 이식센터를 참관하고 매 간이식 전에는 내과, 외과, 마취통증의학과, 중환자의학, 영상의학과, 병리과 전문의가 참석한 다학제간 회의와 강의를 통하여 각 환자의 상태, 영상학적 검토와 수술 및 마취에 관한 논의를 하였다. 마취 시 구비장비로 ROTEM (Pentapharm, Munich, Germany)와 Belmont Rapid infuser (Belmont, Boston, MA, USA), Vigilance II monitor (Edward Lifesciences, Irvine, CA, USA), EV1000 (Edward Lifesciences), bio-pump centrifugal blood pump (Medtronic, Minneapolis, MN, USA), INVOS Cerebral oximeter (Somanetics, Troy, MI, USA)를 구비하였다.
수술실 입실 후, 환자의 등에 제세동 패드를 부착하고, bispectral index, cerebral oximeter를 이마에 부착하였다. 마취 유도는 환자상태에 따라 midazolam, propofol 또는 etomidate, fentanyl, rocuronium 또는 cisatracurium을 사용하였으며 마취 유지는 O2–air-sevoflurane과 remifentanil과 신경근차단제를 지속 정주하였다. 마취 후에는 요골동맥과 대퇴동맥에 카테터를 삽입하여 지속적으로 동맥압을 모니터하여 평균 동맥압은 65 mmHg 이상으로 유지하였으며, 필요 시 norepinephrine을 우선적인 혈관수축제로 선택했다. 내경정맥에 삼중내강 중심정맥카테터와 3 lumen 9 Fr. Advanced Venous Access (Edward Lifesciences) 또는 7 & 8 Fr. MAC Multi-Lumen Access Catheters (Arrow, Teleflex, NC, USA)를 삽입하고 이를 통하여 Swan-Ganz 카테터를 삽입하여 심박출량 모니터를 하였다. 모든 환자는 혈전예방스타킹과 다리공기압축펌프를 착용하고 공기가온블랭킷을 상체 및 하체에 적용하며 식도체온계를 삽입했다. 수술 중 필요한 승압제 및 강심제, 제세동기를 항상 미리 준비하였다. 동맥혈가스분석 및 혈액검사는 정해진 시점(마취 유도 직후, 마취 유도 60분 후, 수혜자 간 적출 10분 후, 재관류 예상 10분 전, 재관류 10분 후, 담도 문합완료 시)에 시행했고, ROTEM은 무간전기, 무간기, 재관류기에 시행하여 수혈 시 임상적 소견과 종합하여 혈액응고이상의 진단 및 치료에 이용하였다.
결 과
2013년 4월부터 2017년 4월까지 본원에서 간이식을 시행 받은 수혜자는 총 49명으로, 뇌사자 간이식군 28명, 생체 간이식군 21명이었다. 모두 성인이었으며 평균 연령 53.5±9.2세, 남자 34명, 여자 15명이었다. 전체 수혜자의 평균 MELD score는 18.8±10.7점이었으며 뇌사자 간이식군은 23.4±11.6점, 생체 간이식군은 12.6±4.6점으로 통계적으로 유의한 차이를 보였다(P<0.001). 원인 질환은 B형간염에 의한 간경화가 20명으로 가장 많았고, 원인이 불명확한 간경화가 3명, 원발성 간세포암이 2명, 선천성 담도폐쇄증으로 카사이 수술을 받은 환자가 1명이었다(Table 1).
공여자와 수혜자의 혈액형 불일치 이식은 4명에서 시행되었고 다장기 이식은 없었다. 수술 전 간신증후군으로 지속적 신대체요법을 받은 7명이 수술 중에도 지속적 신대체요법을 시행하였다. 수술 중 간 적출 후 무간기에 체내 국소 냉각 과정에서 심실세동이 발생한 경우가 1명 있었으며 1회 제세동 후 즉시 회복되었다. 원심펌프를 사용하여 정-정맥우회술법으로 수술을 시행한 경우는 2명이었다. 폐포흉막샛길이 동반된 흉수로 수술 중 교정술을 시행한 경우가 1명 있었다[4].
마취시간은 625±113분, 수술시간은 519±117분이었다. 뇌사자 간이식군보다 생체 간이식군의 경우 통계적으로 유의하게 수술시간이 긴 것으로 나타났으며(P=0.007), 그에 따른 마취시간도 길었다(P=0.015). 무간전기의 경우도 생체 간이식군에서 더 긴 것으로 나타났다(P=0.003). 냉허혈시간은 280±159분이었고 생체 간이식군(156±80분)의 경우 뇌사자 간이식군(372±140분)보다 통계적으로 유의하게 짧았으며(P<0.001), 온허혈시간은 44±17분으로 두 군간 유의한 차이는 없었다. 재관류 5분 내 기존혈압의 30% 이상 저하된 경우가 1분 이상 지속되는 경우로 정의되는 재관류후증후군은 49명 중 17명(34.7%)에서 나타났으며 이로 인한 심정지는 없었다. 수술 중 추정 실혈량은 6,615±4,860 mL였고, 뇌사자 간이식군(8,229±5,270 mL)의 경우 생체 간이식군(4,463±3,268 mL)보다 유의하게 많았다(P=0.006). 수혈은 농축 적혈구 11.1±6.6 unit, 신선동결혈장 14.7±7.3 unit을 사용하였으며 뇌사자 간이식군에서 생체 간이식군보다 유의하게 많이 시행되었다(red blood cell, P=0.005; fresh frozen plasma, P=0.003) (Table 2).
본원에서는 수술 후 조기 발관을 시도하는 패스트 트랙을 적용하지 않고 있어 수술 후 평균 인공호흡기 유지기간은 72.1±95.5시간이었다(사분범위, 16.8–87.3시간). 수술 후 중환자실 재원기간은 평균 11.0±8.3일이었으며 이는 뇌사자 간이식을 받은 수혜자에서 평균 13.6±9.0일로 생체 간이식을 받은 수혜자의 8.0±3.3일보다 통계적으로 유의하게 길었다(P=0.014). 수술 후 평균 입원기간은 45.2±40.7일로 두 군간 차이가 없었다(Table 3).
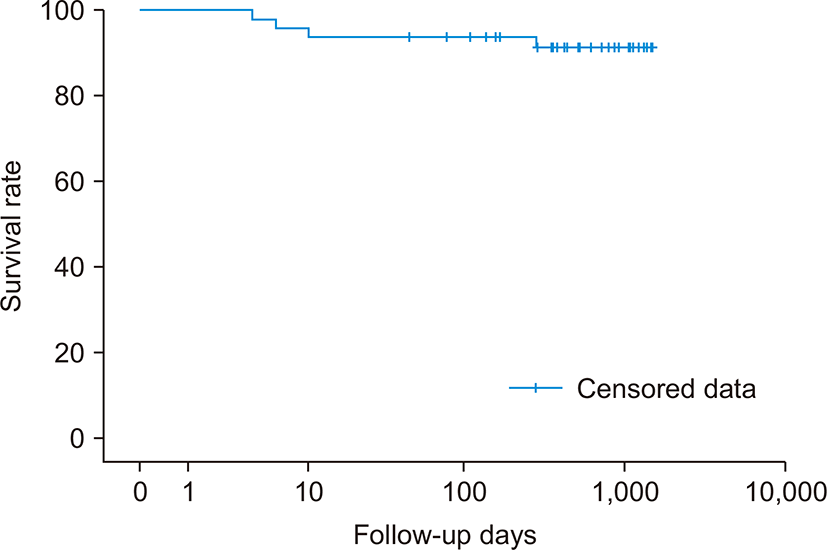
수술 후 가장 많은 합병증은 폐렴(22.9%)이었으며 재수술은 6명으로, 출혈에 의한 혈종배출술이 4명, 장폐색 및 담즙 누출로 인한 수술이 각각 1명씩 있었다. 간이식 후 사망한 사례는 총 4명으로, 수술 후 4일째 다발성 장기부전으로 사망한 예, 수술 후 6일째 급격히 진행된 간부전, 폐출혈로 인한 저혈량성 쇼크 및 다발성 장기부전으로 체외막산소화요법을 시행하였으나 사망한 예, 수술 후 10일째 패혈증으로 사망한 예, 수술 후 228일까지 추적 조사하여 다발성 전이로 인한 합병증으로 사망한 사례였다(Table 4). 이식 후 30일 생존율은 93.8%, 이식 후 3년 생존율은 88.6%로 나타났다(Fig. 1).
고 찰
간이식을 받는 환자들은 질환자체로 인한 마취적, 수술적 위험도가 크다. 이러한 간이식 마취와 수술의 성공요건은 환자의 상태, 수술 전후 관리, 수술의 외과적 기술, 수술 중 관여되는 여러 의료진 사이의 원활한 의사소통 등이 있다.
국내 전반적인 간이식의 성적은 세계적인 추이와 다르지 않아서 2001년 323건이던 간이식이 2015년도에는 1,398건으로 약 4배 가량 증가하였고 전체 1,398건의 간이식 중 456건이 뇌사자 기증에 의해서, 942건이 생존 기증자에 의해서 이루어져 전체 간이식의 67%가 생존 시 기증자에 의해서 이루어지고 있으며[3], 이는 미국의 경우 2016년 한 해 동안 7,268건의 간이식 중 6,985건이 뇌사자 간이식이었고 283건이 생체 간이식이었던 결과와 상반된다[5]. 국내에서 이식 후 수혜자의 3개월, 1년, 5년 생존율이, 생체 간이식 후 각각 93.7%. 89.2%, 80.1%이고 뇌사자 간이식 후에는 각각 82.9%, 78.3%, 50.6%이다[3].
간이식은 외과 수술 중 어렵고 복잡한 분야이므로 대규모 센터를 위주로 많은 환자들이 모이고 국내에서도 주로 대규모 이식센터가 있는 병원에서 간이식을 시행하고 있는 실정이다. 이전 연구들에서는[6] 연간 80례 이상의 간이식을 시행하는 대규모 센터와 연간 50례 미만의 간이식을 시행하는 소규모센터 간 수술결과에 차이를 보인다고 알려져 있는데, 처음 간이식을 시작하는 소규모 센터의 문제점으로는 위와 같은 환자 모집부터 간이식을 전문으로 하는 ‘팀’으로서의 다학제 인력 구축, 간이식 전용 공간의 부재, 수술 및 마취장비 구비, 전문인력을 교육시키는 데 드는 시간적 소요성이 있다. 본원에서도 간이식 경험이 있는 집도의를 중심으로 간이식을 처음 시작하였으며 원내 다학제 간 논의를 모색했다. 그 결과 4년 동안 49례의 비교적 성공적인 결과를 가져올 수 있었다.
간경화의 대표적 원인으로 B형간염 바이러스가 있으며, 본원과 규모가 비슷한 병원의 초기 자료에서도 뇌사자 간이식군, 생체 간이식군 모두 바이러스성 간염에 의한 간질환이 가장 많았다[7].
뇌사자 간이식군보다 생체 간이식군의 경우 통계적으로 유의하게 마취시간과 수술시간이 길었고, 무간전기의 경우도 생체 간이식군에서 유의하게 길었다. 타원의 경우에도 뇌사자 간이식군에서 생체 간이식군보다 짧은 수술시간을 보였다[7]. 이는 수술방법의 차이뿐 아니라, 생체 간이식 수혜자의 경우 대부분 중심정맥관 등이 없고 동맥압 모니터링이나 심박출량 모니터링를 미리 하고 있지 않아서 마취유도 후 이루어지는 환자 감시를 위한 술기가 새롭게 시행될 수 있어서 그 영향이 있었다고 생각된다. 또 생체 간이식의 경우 집도의의 부족으로 공여자에서 간의 구득과 수혜자에서의 개복을 함께 담당하는 경우가 있어 역할을 분담할 수 있는 전문 수술인력이 더 보충된다면 이로 인한 시간을 조금 더 단축 시킬 수 있으리라 생각된다. 뇌사자 간이식의 경우 수혜자의 상태가 생체 간이식을 받는 수혜자보다 좋지 않아 지혈장애 등의 수술 중 출혈의 위험도가 높아 실혈량이 보다 많았으며 이로 인해 수혈량도 유의하게 더 많았던 것으로 생각된다. 그러나 타원의 뇌사자 간이식과 생체 간이식 결과에서는 유의한 차이를 보이지 않았으며[7], 국내 대규모센터 병원의 초기 간이식 경험보고에서 적혈구 53 unit, 신선동결혈장 51 unit을 수혈했던 성적[2]에 비해서는 매우 적은 양의 수혈이 이루어졌다.
MELD score는 간경화 환자의 3개월 후 예후를 예측하는 도구로, 이전에는 Child-Pugh score를 통해 간이식 후 생존율에 대한 평가가 이루어져 간이식 응급도를 구분하였다. 미국 United Network for Organ Sharing에서는 2002년부터 간장의 배분을 MELD score를 근간으로 변경하였으며, 이러한 MELD 시스템은 여러 국가에서 뇌사자 간장분배의 원칙으로 차츰 사용되어왔다. 대한이식학회에서는 2012년 2월 질병관리본부 국립장기이식센터에 대기자 선정기준을 국내 실정에 맞게 재설정해 줄 것을 요청하였으며 질병관리본부 2012년, 2014년도 연구용역과제를 통하여 MELD 시스템이 국내 간장 응급도 기준으로 적합하다고 보고하였다[8]. 이에 2016년 6월 1일부터 국내 간장 응급도 기준이 MELD 시스템으로 전환되어 운영되게 되었다. 말기 간질환 환자에서 MELD score가 증가되는 것은 다발장기부전이나 패혈증으로 진행하는 것을 의미할 수 있으므로[9], 높은 MELD score를 가진 환자에서 간이식이 시행될 때 보다 주의를 기울여야 하며 특히 30일 간격 측정 시 MELD score가 증가하는 경우가 3개월내 사망률이 높다고 밝혀져 있어[10] 최근 30일 내 급격한 MELD score의 상승을 보인 환자는 유념해야 한다. 본원에서는 MELD 시스템 도입 후 13건의 간이식이 시행되었는데 이중 3명의 환자가 수술 후 각각 4일, 6일, 10일 후 사망하였으며 이들의 MELD score는 48, 12, 21점이었고, 원인은 각각 다발성장기부전, 심부전, 패혈증이었다. 이는 이전의 35명 중 1명이 간세포암 재발로 인해 사망했던 것에 비해 환자들의 사망률이 높아진 것을 알 수 있었다.
수술 후 조기 발관에 대한 논의는 계속되고 있는데 Fullington 등[11]은 소아 간 이식 후 즉시 발관을 시행한 군에서 중환자실 재원일 수를 줄이고 총 입원일수를 줄이는 데 영향을 미친다고 보았다. 하지만 Findlay 등[12]은 간이식에서 패스트 트랙 마취가 수술 후 기계호흡시간은 줄이지만 중환자실 재원을 유의하게 줄이지 못했다고 하였다. 본원에서는 패스트 트랙을 적용하고 있지 않아 기계호흡을 유지하고 중환자실 이동 후 충분히 환자상태가 안정화 되었을 때 24시간 내 진정약물을 끊고 의식을 확인하고 인공호흡기를 제거하려는 노력을 하고 있다. 이로 인해 기계호흡 유지기간은 두 군간 통계적으로 유의한 차이가 없었으나 중환자실 재원 일수는 수술 전 MELD score가 상대적으로 높았던 뇌사자 간이식군이 수술 후 합병증의 위험도가 높아 중환자실 재원일수가 통계적으로 유의하게 길어졌다고 생각한다.
수술 후 가장 많은 합병증은 폐렴으로 이에 대한 원인으로 시기별로 고려해 볼 수 있다. 이식 초기 폐렴의 경우 중요한 원인으로는 수혜자의 면역억제제 사용으로 면역기능이 억제되어 있는 상태에서 다양한 병원감염성 원인균에 노출됨으로써 발생되는 것이 크다고 생각된다. 또 조기 발관을 하지 못하고 기계호흡을 유지하는 상태에서는 이러한 원내감염성 폐렴이 장기간 지속될 수 있다. 수술 후 폐렴의 빈도는 5%–38%까지 다양하게 보고되고 있으며[13,14], Pirat 등[13]은 간이식 후 폐렴은 22.7%의 발생률을 보였으며 이것은 기계호흡 기간이 연장될수록 악화되어 40%의 치사율을 보였다고 보고하였다. 또 Ikegami 등[15]은 이러한 수술 후 세균성 폐렴은 수술 후 6일째에 가장 높게 나타났으며 8일째와 9일째에 감소하는 양상을 보인다는 보고하였다.
1988년 국내 간이식을 처음 시작한 병원의 경우 1995년 발표된 초기 간이식 경험에 대한 보고에서, 당시 16건의 간이식 환자 중 9명이 생존하고 있었으며, 최장기간 생존자는 7년 5개월이었다[2]. 당시에는 소아 환자가 간이식을 더 많이 받아 현재의 상황과 절대적 비교는 어렵지만 현재 해당병원의 이식 후 5년 생존율은 83%이며 또다른 대규모의 간이식센터의 경우, 1995년 3월 처음 간이식 수술을 시작하여 2017년 1월까지 500례를 기록하였으며 이식 후 평균 생존율이 이식 후 3년 84.6%, 5년 78.9%이다. 간이식 역사가 긴 미국의 평균 간이식 후 3년, 5년 생존율이 82.7%, 79.7%인 점과 비교하여 세계적 수준의 결과를 보인다[16]. 본원과 규모가 비슷한 2006년 간이식을 시작한 국내 또다른 병원의 경우, 2009년까지의 환자들을 대상으로 초기 성적을 보고한 바에 따르면 전체 환자들의 5년 생존율은 85.8%로 나타났다[8]. 본원의 현재까지의 이식 후 3년 생존율은 88.6%로, 세계적 수준의 성적과 비슷한 추이를 보이고 있어 소규모 센터에서도 충분히 성공적 간이식이 가능하다는 것을 보여주었다는 점에서 의의가 있다고 본다. 따라서 위 사례들과 비추어 볼 때, 본원의 현재까지의 간이식 성적은 주목할 만 하다.
결론적으로 이대목동병원에서의 4년간의 초기 간이식 경험은 현재 간이식 선도 병원들의 초기 결과를 상회하는 결과를 보여주고 있다. 이는 면역억제제의 개발과 의료기기 등의 의료기술의 발전으로 과거 소규모 센터가 가졌던 한계점을 극복하고 대규모 센터와의 격차를 줄였다는 점으로 해석할 수 있다. 또한 지금도 여러 병원에서 간이식을 새로 시작하는 단계에 있는데, 외과와 마취통증의학과뿐 아니라 각 부서에서도 철저한 준비를 하고 다학제간의 협력을 바탕으로 병원 차원에서의 행정적 뒷받침이 잘 이루어진다면 얼마든지 소규모 이식센터에서도 성공적으로 간이식을 시행할 수 있을 것이라 생각한다.