서 론
위장관 림프종은 전체 위장관 종양의 1%–4%로 드물게 나타나지만[1], 림프절 외 림프종 중 가장 흔하며 전체 림프종의 5%–20%를 차지한다[2]. 위장관 림프종의 해부학적 위치에 따른 발생 빈도는 위에서 50%–60%로 가장 흔하고, 소장 20%–30%, 대장 10%–20% 순서이며, 직장을 단독으로 침범하는 경우는 1%–2%로 매우 드물다.
위장관 림프종 중 가장 흔한 아형은 B세포 기원의 점막연관 림프조직(mucosa-associated lymphoid tissue, MALT) 림프종이다[3,4]. MALT 림프종은 림프절외 장기의 점막연관 림프조직에서 발생하는 저등급 림프종(low grade lymphoma)으로, 위장관 중에서는 위에서 가장 많이 발생하고 대장-직장의 경우 5% 미만으로 역시 드문 것으로 되어 있다[4,5]. MALT 림프종 중 10%–15%에서 고등급 림프종(high grade lymphoma)로 형질전환(higstologic transformation)되는 것으로 알려져 있다[4,6]. 원발성 림프종이 매우 드문 직장에서, 소포 림프종(follicular lymphoma), MALT 림프종, B-미만성 대세포 림프종 각각에 대한 보고는 국내외적으로 수차례 있어 왔으나[7,8], MALT 림프종에서 B-미만성 대세포 림프종으로 형질전환된 사례는 보고된 바가 없다. 저자들은 직장의 MALT 림프종에서 B-미만성 대세포 림프종으로 형질전환된 1예를 경험하였기에 이에 관한 문헌 고찰과 함께 보고하는 바이다.
증 례
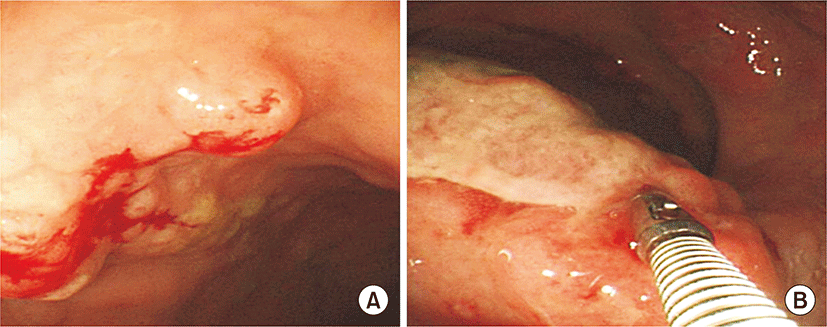
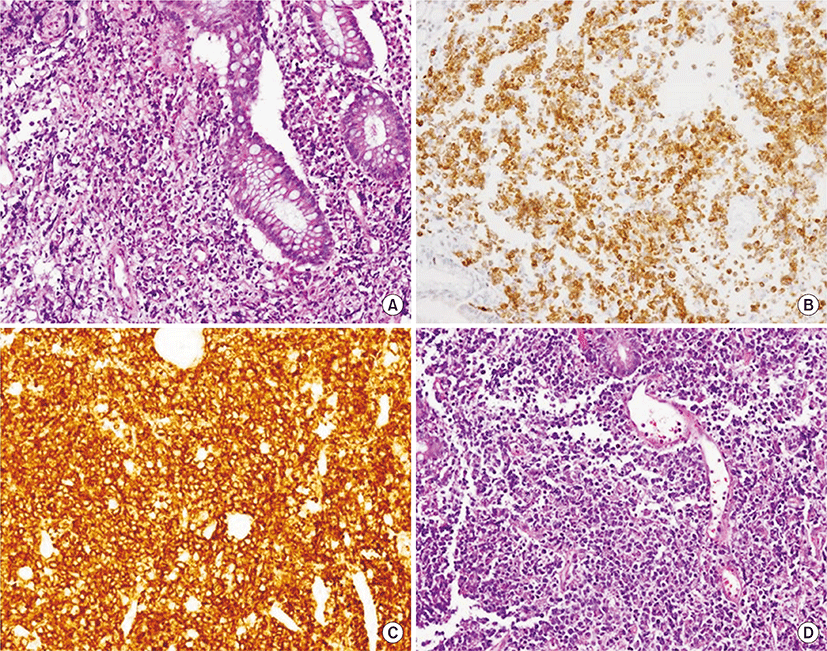
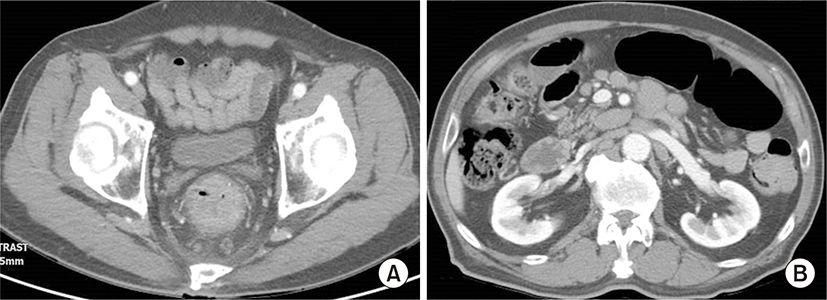
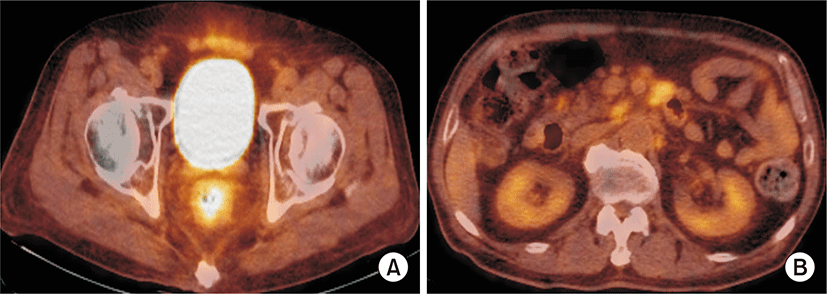
75세 남자 환자가 1개월 전부터 시작된 혈변과 복통, 항문 뒤무직 증상으로 소화기내과 외래로 내원하였다. 병력에서 최근 6개월 간 5 kg의 체중감소가 있었고, 발열이나 야간 발한 등의 증상은 없었다. 환자는 당뇨, 고혈압, 결핵 등의 과거력은 없었고, 사회력과 가족력에서도 특이사항은 없었으며, 활력징후는 안정적이었다. 신체검진에서 복부에 약간의 압통이 있었으나 반발 압통은 없었고, 서혜부, 경부, 액와부위 등에 촉지되는 림프절 종대는 없었다. 항문주위에 육안으로 이상소견은 없었으나, 직장 수지검사에서 직장벽에 단단한 종물이 촉지되었다. 외래에서 시행한 대장내시경검사에서 직장과 구불결장 주변의 다발성 결절과(Fig. 1A) 항문연 5 cm 상방의 궤양융기형(ulcerofungating) 종괴가 관찰되어 조직검사를 시행하였다(Fig. 1B). 조직 병리 검사에서 다발성 결절에서는 MALT 림프종으로 확인되었고, 궤양융기형 병변에서는 CD-20 (+), CD-3 (-), bcl-2 (+), bcl-6 (+)의 B-미만성 대세포 림프종이 확인되었다(Fig. 2). 그는 혈액종양내과로 입원하였고 혈액 검사에서 백혈구 4,330/mm3, 혈색소 13.6 g/dL, 혈소판 282,000/mm3이었으며, 혈액도말 검사상 경도의 백혈구감소증 소견 보였고, lactate dehydrogenase (LDH) 322 IU/L 상승되어 있었다. 복부 computed tomography (CT) 검사에서 직장 주변의 다른 장기의 침범 없이 직장 주변 영역림프절의 종대가 있었고 후복강에 대혈관 및 장간막 주위에 다양한 크기의 림프절 종대가 있었다(Fig. 3). 흉부CT와 경부CT는 정상 소견이었고, 골수 검사 및 위 내시경 검사에서도 특이 소견 없었다. 전신 양전자방출단층 촬영(Fluorine-18-fluoro-2-deoxy-D-glucose positron emission tomography-computed tomography(18F - FDG PET CT)) 에서 직장과 주변 림프절 및 후복강내의 림프절에서 FDG 대사가 증가되어 림프종의 침범을 시사하였다(Fig. 4). 환자는 Lugano 분류법에 따라 stage II2의 원발성 직장 림프종으로 진단하였고[9], MALT 림프종과 B-미만성 대세포 림프종이 연속된 동일 병변에 있었으므로 직장 MALT 림프종에서 형질전환된 B-미만성 대세포 림프종로 핀단하였다. 환자는 항-CD20 단클론 항체를 포함하는 복합항암요법(R-CHOP: rituximab, cyclophosphamide 750 mg/m2 day 1, doxorubicin 50 mg/m2 day 1, vincristine 1.4 mg/m2 day 1, prednisone 50 mg/m2 day 1 to 5)으로 6회 치료 후 완전관해를 보였고, 12개월째 무병상태를 유지 중이다.
고 찰
원발성 위장관 림프종은 림프절 외 림프종이 가장 흔하게 발생하는 곳으로 전체 림프종의 5%–20%를 차지하지만, 이중에서도 하부 위장관에서 발생하는 경우는 매우 드물다[2]. 1960년대에 Dawson 등[10]에 의해 확립된 분류 기준에 따르면, 초기 진찰시 만져지는 표재성 림프절을 갖지 않고, 흉부 영상 검사에서 명확한 종격동 림프절 종대 소견이 없으며, 백혈구 백분율과 혈액도말검사에서 정상이고, 개복술에서 위장관 병변이 분명하고 주위 림프절 종대만 확인되어야 하며, 끝으로 연속 병변에 의한 직접전파를 제외한 간과 비장에 림프종 침범이 없는 경우를 원발성 위장관 림프종으로 정의하였다. 본 증례에서는 직장 병변 및 그와 관련된 혈변 증상으로 내원하였고, 후복강 림프절종대를 제외하고는 종격동 림프절 종대나 간 또는 비장 등의 침범 소견이 없었으며, 일반 혈액검사에서 이상소견이 없었다.
림프종의 형질전환이란 소포 림프종이나 MALT 림프종과 같은 저등급 림프종에서 B-미만성 대세포 림프종이나 Burkitt 림프종 같은 고등급 림프종으로 전환되는 것으로, 저등급 림프종의 자연경과에서는 비교적 잘 알려진 내용이다[6]. 그러나 MALT 림프종에서 형질전환 예는 Helicobacter pylori 감염과 관련된 위나 십이지장 등에서 발생이 대부분이며[4,11], 직장에서 형질전환된 MALT 림프종의 예는 매우 드물어 전세계적으로도 보고된 바가 없다. 형질전환 림프종의 정의는 확실하게 정해진 바는 없어, 기존의 연구들마다 세포조직학적 확인부터 임상경과만으로 확인하는 방법까지 다양하게 정의되어 왔다[6]. 원칙적으론 병리 조직에서 저등급 림프종과 고등급 B-세포 림프종의 세포 판 또는 집단이 함께 확인되거나[12], immunoglobulin heavy chain에 대한 중합효소 연쇄 반응(polymerase chain reaction)검사로 양 조직의 동일 클론성을 밝히는 것이 필요하겠지만[13], LDH의 상승, 갑작스런 림프절의 크기 증가, B-증상(체중 감소, 야간 발한, 발열), 과칼슘혈증의 발생으로 진단하기도 한다[14]. 본 증례의 경우, 추가적인 immunoglobulin heavy chain 검사가 이뤄진 것은 아니지만, 직장내 다발성 결절 모양의 MALT 림프종 병변과 연속적으로 B-미만성 대세포 림프종 병변이 있었기에 MALT 림프종에서 전환된 B-미만성 대세포 림프종으로 판단하였다.
일반적으로 형질전환된 림프종의 경우, 형질전환된 고등급 림프종의 조직 아형에 맞추어 치료한다. B-세포 계열의 형질전환 림프종의 경우 rituximab치료가 시작된 이후 유의한 발전이 있었지만, 형질전환 림프종의 예후는 상대적으로 불량한 것으로 알려져 있다[6]. 대장의 B-미만성 대세포 림프종의 경우 수술적 치료 역할이 비교적 잘 밝혀져 있어서, 국소 병기 질환의 경우 수술적 절제가 좋은 예후를 보이는 것으로 보고되었고, 진행된 병기에서도 출혈, 천공 등과 같은 심각한 합병증 위험성을 조절하기 위해 적극적 종양감축술(debulking surgery) 시행에 이은 전신 항암치료가 효과적인 것으로 밝혀져 왔다[15]. 그러나 직장의 B-미만성 대세포 림프종의 경우, 특징적인 해부학적 구조와 이에 따른 특징적인 임상양상으로 대장의 병변과 달리 수술적 치료의 역할이 불확실하다. 직장의 병변은 수술적 접근이 상대적으로 어렵고, 항문 보존과 관련된 기능적 문제가 있으며, 직장주변으로 연속된 조직이 있어 치료 관련 천공 등 위험성이 상대적으로 낮기 때문으로 여겨진다. 따라서, 직장 B-미만성 대세포 림프종의 치료는 수술적 치료보다는 항암화학요법 혹은 방사선 치료 위주로 적용되어 왔다. 그러나 직장 B-미만성 대세포 림프종의 치료와 관련된 문헌들은 증례 보고 혹은 작은 규모의 후향적 연구가 대부분으로 치료에 대한 논란은 지속되고 있다[7,15]. 본 증례는 후복강의 림프절 종대를 동반하였으나 직장 주변 장기로 직접 침윤이 없었던 환자로, 수술과 같은 국소 치료 없이 전신 항암화학요법만을 적용하여 치료 관련 부작용 없이 완전 관해를 유도하였다.
본 증례에서 직장의 MALT림프종에서 전환된 B-미만성 대세포 림프종 환자를 경험하였고, 형질전환된 림프종의 경우에서도 수술과 같은 국소 치료 없이 전신 항암화학치료로 완전 관해를 유도할 수 있었다.