서 론
위장관에서 발생하는 종양은 대부분 선암으로 상피 세포종양이지만 드물게 간질종양을 볼 수 있다. 위장관간질종양(gastrointestinal stromal tumor, GIST)은 간엽조직기원의 종양으로서 위장관에서 발생하며 모든 위장관 종양의 1% 미만으로 비교적 드문 편이다[1]. 위장관간질종양은 면역조직화학 기법으로 확인할 수 있는 CD117이라는 원발암유전자를 발현하는 간엽성종양으로서, 위장관간질종양이 가장 호발하는 부위는 위(60∼70%), 소장(20∼25%) 순이며, 직장에서의 발생률은 5% 미만으로 알려져 있다[2-4]. 저자들은 변비로 발현한 직장에 발생한 위장관간질종양 1예를 경험하여 문헌고찰과 함께 보고하는 바이다.
증 례
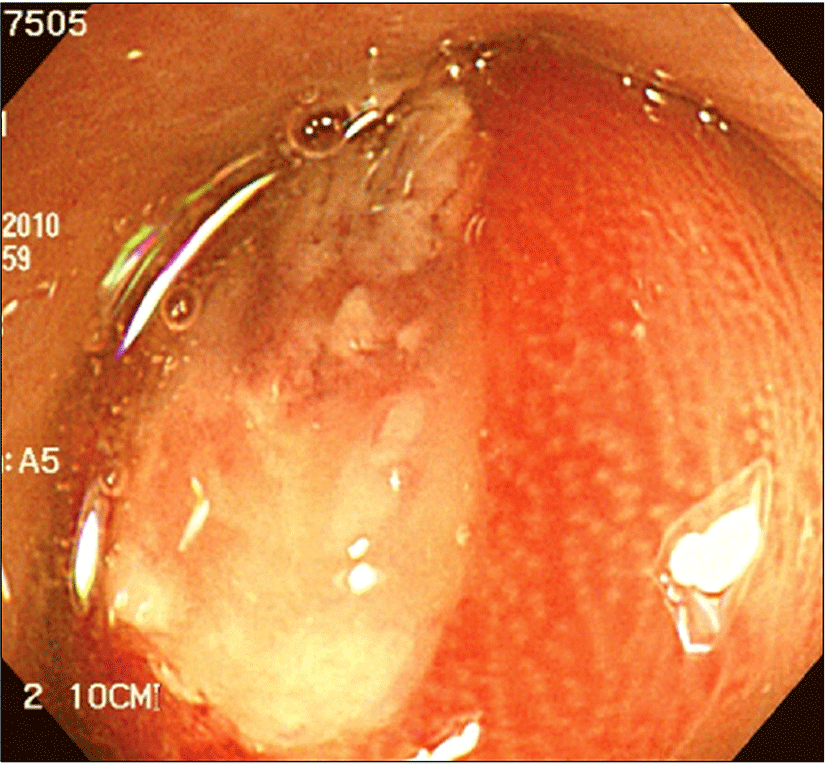
61세 여자 환자가 일주일 이상의 변비를 주소로 본원 응급실로 내원하였다. 내원 당시 혈압은 120/60 mm/Hg, 호흡 15회/분, 맥박 88회/분, 체온은 36.8°C로 정상이었다. 신체 진찰에서 환자는 만성 병색을 보였고, 흉부 청진에서 심박동은 규칙적이었고, 심잡음은 들리지 않았으며, 폐청진도 정상이었다. 복부 소견에서 압통이나 반동압통은 없었으나 장음은 항진되어 있었고 촉진되는 장기나 종괴는 없었다. 말초혈액검사에서 백혈구가 13,300/mm3로 증가된 소견 외에 특이한 소견은 관찰되지 않았고, 혈액 생화학 검사에서도 CEA 2.5 ng/ml, CA19-9<0.6 U/ml로 정상 범위였다. 내원 후 시행한 단순 흉부 방사선에서 이상소견은 관찰되지 않았고, 단순 복부 방사선에서 장내 분변이 차있는 것 외에 특이 소견은 없었다. 직장수지검사에서 항문 괄약근은 정상 긴장도를 보였으나 5 cm 이상의 둥글면서 딱딱한 종괴가 촉진되어 소화기내과로 전과되어 종양에 대한 평가를 진행하였다. 대장내시경 결과 항문연 직상방에 표면에 궤양이 동반된 8 cm의 거대한 종괴가 관찰되었으며(Fig. 1),
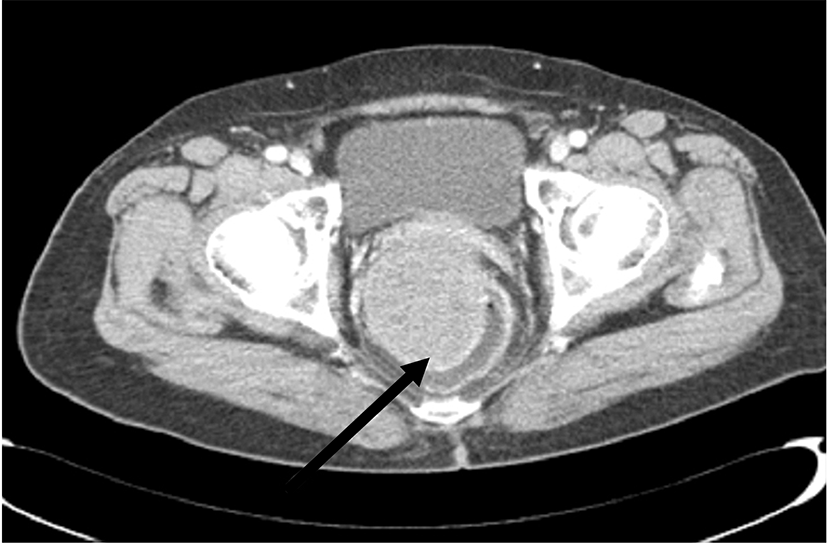
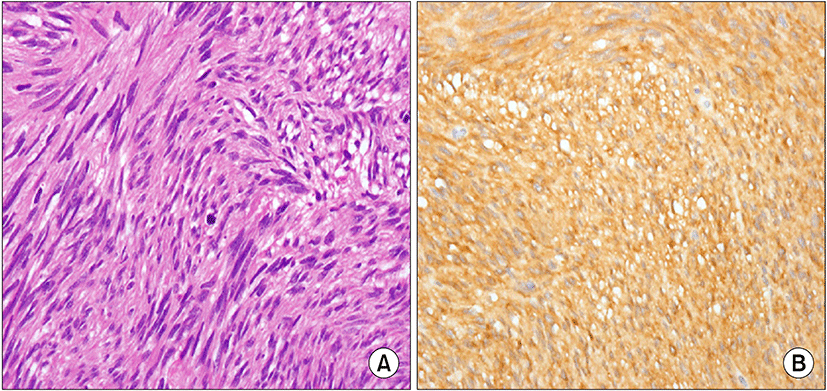
복부전산화단층촬영에서는 직장의 전외벽부터 내강으로 돌출되어 있는 7×5.3×6.2 cm 가량의 근육과 동일한 조영증강을 보여(Fig. 2) 위장관간질종양과 같은 연부조직 종양이 의심되어 확진과 치료를 위하여 저위전방절제술을 시행하였다. 병리학적 소견에서 육안적으로 8.0×7.0×6.0 cm 크기의 종괴가 관찰되었으며, 절제연에서의 종양세포의 침윤은 관찰되지 않았고, H&E 염색결과 난원형과 방추형 세포가 관찰되었으며 면역조직화학염색결과 CD117 양성, CD34 양성, S-100은 음성으로 위장관간질종양으로 진단할 수 있었다(Fig. 3). 유사분열은 9 mitoses/50 high power field (HPF)로 고위험군으로 평가되었다. 수술 후의 경과는 양호하여 환자는 수술 후 12일째 퇴원하였으며 수술적 절제 후, 재발 감소를 위해 GleevecⓇ (imatinib mesylate)을 투여하고 있으며, 저위전방절제술 5개월 후 장루복원술을 시행 받고 외래에서 추적관찰 중이다.
고 찰
위장관간질종양의 발생빈도는 매우 낮은 편으로 모든 위장관 기원 종양 가운데 1% 미만인 것으로 알려져 있으며, 인종과 지역, 성별에서의 빈도 차이는 분명하지 않다. 위장관간질종양의 발생 연령은 40대 이후에서 많이 발생하고 40세 이전에는 드문 것으로 알려져 있고 평균연령이 50∼60세로 알려져 있으며, 발생부위는 보통 위에서 70%, 소장에서는 20∼30%, 식도와 대장 및 직장에서는 10% 미만, 특히 직장에서는 5% 미만인 것으로 알려져 있다[2-4].
임상증상은 종양 위치와 크기에 따라 다르게 나타날 수 있는데, 대부분은 배변습관의 변화, 통증, 위장관 출혈, 장폐쇄, 복부 종괴의 촉지 등의 대장에 발생하는 악성 종양의 증상들이 일반적으로 나타날 수 있는 것으로 되어 있다. 국내에서 보고된 직장의 간질종양들을 검토해보면 혈변, 배변습관의 변화, 복부 통증 등의 증상으로 내원하여 진단되는 경우가 다수였으며, 종양의 전립선으로의 침범 및 방광 압박으로 인한 배뇨곤란 및 빈뇨를 주소로 내원하여 진단된 경우도 있었다[5-8]. 본 증례의 경우 8 cm 가량의 직장 종괴로 인해 배변습관이 변화되어 변비를 주소로 내원한 경우였다.
진단은 직장수지검사와 대장내시경, 경직장내시경초음파가 필수적으로 본 증례에서는 경직장내시경초음파는 시행하지 못하고 복부전산화단층촬영을 시행하여 직장 전외벽의 돌출된 종괴가 근육과 동일한 조영증강을 보이고 점막 손상 없이 내강으로 외향성성장(exophytic growth patthern)을 보여 위장관간질종양의 가능성을 제시하였다. 확진은 내강 돌출형의 경우 중심부 생검을 통해 가능하나, 대부분 수술 후 병리조직학적인 진단으로 한다[9].
Lim 등[10]의 연구에 의하면 종괴의 성장 형태에 따라 점막하 형태(intraluminal), 장막하 형태(extraluminal), 점막하형과 장막하형의 혼합된 형태로 나타나는 아령 형태(dumbell) 및 벽내 형태(intramural) 등 네가지로 분류하고, 이 중 점막하 형태가 가장 많았고(56.5%) 다음으로 아령 형태(35.5%)와 장막하 형태(8.0%) 순으로 보고 하였다.
위장관간질종양은 면역조직화학적으로 거의 모든 부위의 악성과 양성의 예에서 tyrosine-kinase growth factor receptor인 CD117 (c-kit 단백)을 발현하고, CD117 외에 CD34도 60∼70%의 위장관간질종양에서 양성을 보이며 SMA (smooth muscle antigen)는 20∼40%의 양성률을 나타내며 일반적으로 desmin과 S100에는 음성을 보인다. Miettinen 등[11]의 연구에 따르면 CD34는 소장에 발생한 간질종양에서 50%의 양성률을 보이는데 반해 직장에 발생한 간질종양에서 92%의 양성률을 나타냈으며, SMA의 경우 소장에서 발생한 간질종양의 47%에서 양성을 보이고 직장에 발생한 간질종양의 14%에서 양성을 보였다. 이러한 면역 염색 차이의 원인에 대해 명확히 밝혀지진 않았으나, 발생하는 부위에 따라 기원이 달라 병의 경과 및 예후의 차이와도 관련 있을 것으로 생각되고 있다.
직장에 발생한 위장관간질종양은 위나 소장에서 보다 발생 빈도가 낮기 때문에 임상 및 병리조직학적으로 특성이 정립되지 않아 다른 부위 특히 위에 발생한 위장관간질종양의 예후인자를 빌어 사용하고 있다. 가장 중요하면서 쉽게 측정 가능한 조직학적인 예후인자는 종양의 크기와 유사분열의 수이다. 일반적으로 크기가 5 cm 이하이고, 유사분열의 수가 5/50 HPF 이하를 양성으로, 유사분열수가 5개 이하이지만 크기가 5 cm 이상이면 경계성, 크기에 상관없이 유사분열수가 5개 이상이면 악성으로 분류하자는 주장도 있었지만, 간혹 크기가 2 cm 이하이고, 유사분열수도 5개 이하인 종양에서도 종종 전이가 발견되는 경우도 있어서 최근에는 악성과 양성이라는 개념보다는 저위험군(low risk)과 고위험군(high risk)이라는 용어로 대치되고 있다. 위장관간질종양의 위험 평가도 종양의 크기와 유사분열의 수를 토대로 분류되고 있다[12]. 본 증례에서는 크기가 8 cm이고, 유사분열은 9/50 HPF로 관찰되어 고위험군의 위장관간질종양으로 진단되었다.
위장관간질종양은 비교적 성장 속도가 늦고 원격전이도 늦게 나타나므로 크기와 관계없이 적극적으로 절제를 하면 예후가 좋다고 알려져 있어[13], 특히 저위험군의 위장관간질종양일 경우 외과 근치 절제술이 원칙이며, 직장 위장관간질종양인 경우 종양의 크기와 위치에 따라 국소절제술, 저위전방절제술, 복회음절제술 등을 포함한 다양한 수술 치료가 시행되고 있다[14]. 최근 tyrosine-kinase inhibitor인 imatinib mesylate (GleevecⓇ)를 이용한 선행화학요법은 수술적으로 근치 절제가 불가능한 악성 위장관간질종양의 수술절제를 증가시키고 수술시기의 선택의 폭을 증가시키고 있다[15]. 또한 고위험군 위장관간질종양인 경우 또는 완전히 절제하지 못하였을 경우에 수술 후 보조적인 항암화학 치료로 사용되고 있다[16]. 본 증례의 환자는 고위험군의 직장 위장관간질종양으로 수술 후 GleevecⓇ을 유지하고 있다. 최근의 대규모 연구에서 Imatinib mesylate가 진행암, 전이암에 대한 유효한 치료로 받아들여지고 있으나 아직까지는 용량과 사용기간에 대해 정확히 정립되지 못한 상태로 이에 대한 연구가 더 필요한 실정이다.